A pesar de ser la única terapia médica ambulatoria autorizada para prevenir que empeoren los síntomas del COVID-19 en pacientes de alto riesgo, sigue sin haber un suministro constante de anticuerpos monoclonales por parte del gobierno federal un año después de su aprobación para el uso por parte de los reguladores médicos.
Las terapias con anticuerpos monoclonales, que se pusieron en marcha el mismo mes que las vacunas contra el COVID-19, no han recibido la misma atención que las vacunas, después de que estas fueran anunciadas como la salida de Estados Unidos de la pandemia.
Incluso hoy, el presidente Joe Biden sigue centrándose sobre todo en vacunar a los niños, proporcionar refuerzos a todos los adultos y aumentar las pruebas como parte de sus “nuevas acciones” para combatir la pandemia de COVID-19 durante el invierno.
El Dr. Marc Siegel, internista practicante y profesor de medicina en el Centro Médico Langone de la Universidad de Nueva York, afirma que las vacunas por sí solas no pueden librar a Estados Unidos de la pandemia. Se están produciendo más casos de infecciones posvacunas con las variantes delta y ómicron, y las hospitalizaciones están aumentando este invierno.
Más de 206 millones de estadounidenses están totalmente vacunados y 72 millones de personas han recibido una dosis de refuerzo hasta el 5 de enero. Se considera que las personas están totalmente vacunadas si han recibido dos dosis de las vacunas de ARN mensajero o una única dosis de la vacuna de Johnson & Johnson.
Siegel dijo que la Administración de Biden no ha sido capaz de ofrecer ninguna terapéutica para el tratamiento temprano de las personas con COVID-19 leve o moderado debido a la “obsesión de la administración por las vacunas, excluyendo todo lo demás”.
“Cuando se trata de la terapéutica, los resultados del equipo de Biden son aún más anémicos”, escribió Siegel en un artículo de opinión en USA Today. “Paxlovid, el nuevo fármaco milagroso inhibidor de la peptidasa de Pfizer, ha sido aprobado pero es escaso”.
“Lo mismo ocurre con los anticuerpos monoclonales, los anticuerpos neutralizantes sintéticos que han sido tan útiles en pacientes con alto riesgo de complicaciones u hospitalizaciones. Ómicron es más susceptible al sotrovimab, fabricado por GlaxoSmithKline, pero en la mayoría de los estados es casi imposible de encontrar”, añadió.
The Epoch Times se ha puesto en contacto con el gobierno de Biden para pedirle comentarios.
El Departamento de Salud y Servicios Humanos de EE. UU. (HHS, por sus siglas en inglés) ha entregado más de 197,000 dosis de los tratamientos con anticuerpos monoclonales a los departamentos de salud estatales y de los territorios, y a las entidades federales para la semana del 3 de enero, después de que la agencia interrumpiera brevemente la distribución de los tratamientos el 23 de diciembre.
La falta de mensajes públicos

Las terapias con anticuerpos monoclonales han demostrado ser eficaces para prevenir la enfermedad grave o la hospitalización en pacientes de alto riesgo con COVID-19 leve a moderado. Se diferencian del plasma de convaleciente de un paciente con COVID-19 que se ha recuperado, en que los anticuerpos monoclonales se “crean [en un laboratorio] para dirigirse específicamente a una parte esencial del proceso infeccioso”, según los médicos del Sistema de Salud de la Universidad de Michigan.
Desde el 16 de diciembre de 2021, los Institutos Nacionales de la Salud no recomiendan el plasma de convaleciente para tratar a los pacientes hospitalizados sin inmunidad humoral deteriorada.
Los primeros tratamientos con anticuerpos monoclonales recibieron la autorización de uso de emergencia (EUA, en inglés) en noviembre de 2020, pero parecía haber poco interés en utilizar la terapia cuando el foco estaba en la campaña para vacunar a cada persona de 16 años o más.
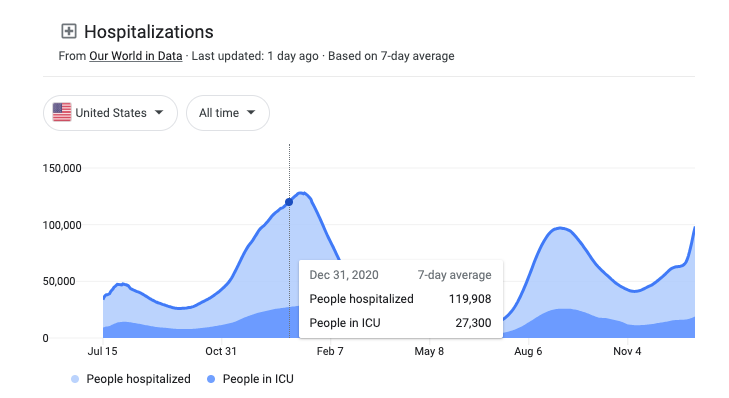
La falta de difundir la información en torno a los tratamientos con anticuerpos monoclonales por parte de las autoridades federales hizo que la gente no fuera consciente del corto plazo para recibir estas eficaces terapias (en los 10 días siguientes a la aparición de los primeros síntomas) y que algunos hospitales se negaran a utilizarlas. Esto condujo a una baja demanda de los anticuerpos monoclonales en un momento en el que deberían haberse utilizado para ayudar a aliviar la presión en los hospitales, ya que Estados Unidos estaba informando de más de 100,000 personas hospitalizadas por o con COVID-19 a finales de diciembre de 2020.
El Dr. Peter McCullough, internista, cardiólogo y epidemiólogo, dijo en una entrevista con el programa “American Thought Leaders” de EpochTV que estaba “asombrado con la falta de fanfarria sobre los anticuerpos monoclonales, casi no hubo aceptación”.
“Hemos oído informes de que más del 80% de los suministros estaban en las estanterías. No se informó a los asilos, ni a los centros de urgencias, ni a los hospitales. No había ningún mensaje”, añadió.
The Epoch Times se puso en contacto con los CDC para pedirles que comentaran la falta de información sobre la terapia COVID-19 y se le dijo que se pusieran en contacto con la FDA, que no había respondido antes de la publicación de este reporte.
Debido a la escasa aceptación, el HHS permitió a los proveedores de atención médica autorizados pedir las terapias directamente al proveedor desde febrero de 2021 hasta el 13 de septiembre de 2021. Pero la aparición de la variante delta y la disminución de la eficacia de la vacuna hicieron que aumentara la demanda de las terapias, lo que llevó al HHS a anunciar que volvería a tomar el control de la distribución.
El número de anticuerpos monoclonales asignados a cada estado y territorio se basaría en el número de casos, las hospitalizaciones y la utilización, un sistema de distribución que se sigue usando en la actualidad.
En el anuncio del 13 de septiembre, el HHS afirmaba que la variante delta había provocado un aumento de los usos de la terapia con anticuerpos monoclonales, “sobre todo en zonas del país con bajas tasas de vacunación”, sin más aclaraciones.
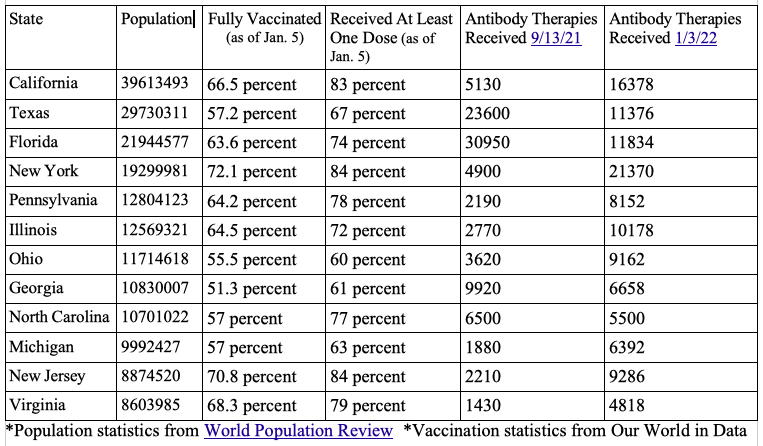
Si se observan las estadísticas del propio HHS y se compara la tasa de vacunación y los anticuerpos monoclonales distribuidos en los 12 estados más poblados, no siempre se observa una correlación entre una baja tasa de vacunación y una mayor utilización de las terapias.
La aparición de la variante ómicron aumentó la confusión sobre si ciertas terapias de anticuerpos debían seguir utilizándose y si seguirían siendo eficaces clínicamente, sobre todo cuando el HHS detuvo la asignación de los tratamientos dos días antes de Navidad.
El 23 de diciembre, el HHS emitió una notificación en la que anunciaba que suspendería la distribución de las terapias de anticuerpos de REGEN-COV y Eli Lilly, basándose en estudios in vitro o “de probeta” —que aún no han sido revisados por expertos de forma independiente— en los que se descubrió que los tratamientos de anticuerpos podrían no ser tan eficaces contra la variante ómicron, dejando el sotrovimab de GlakoSmithKline como único tratamiento disponible.
The Epoch Times se ha puesto en contacto con los dos fabricantes de medicamentos para pedirles comentarios. Eli Lily no ha respondido y Regeneron nos ha remitido a su comunicado de prensa del 16 de diciembre (pdf), en el que se afirma: “Aunque los anticuerpos REGEN-COV de Regeneron actualmente autorizados tienen una potencia reducida contra ómicron, son activos contra delta, que actualmente es la variante más prevalente en Estados Unidos”.
La empresa dijo que está a la espera de la aprobación de un ensayo clínico de sus anticuerpos monoclonales de “próxima generación”, que serían activos contra la variante ómicron y todas las variantes preocupantes.
¿Eficacia ante ómicron?
El Dr. Joseph A. Lapado, director de Salud Pública del Estado de Florida, dice que los resultados de un estudio realizado en un laboratorio no concluyen necesariamente el mismo resultado en los seres humanos.
“Así que la evidencia de laboratorio indicaba que la afinidad de los anticuerpos, como los anticuerpos Regeneron para la variante ómicron fueron reducidos … pero eso no es lo mismo que concluir que los anticuerpos monoclonales Regeneron no funcionará en un paciente con ómicron”, dijo Lapado en una conferencia de prensa el 3 de enero.
“Por tanto, hay una diferencia entre los datos de laboratorio y los datos clínicos. Y ellos tomaron la decisión de retener la medicación basándose en los datos de laboratorio, pero a nosotros nos importan los resultados clínicos. Las decisiones deben basarse, obviamente, en los datos clínicos, y por eso han revertido [la pausa]”, añadió.
El HHS levantó la pausa ocho días más tarde, el 31 de diciembre, permitiendo a todos los estados y territorios seguir ordenando los tratamientos, citando que “la prevalencia de las variantes de COVID-19 sigue siendo dinámica”. La decisión también fue “a la luz de las recientes directrices clínicas de los Institutos Nacionales de Salud (NIH) publicadas el 30 de diciembre de 2021, y la significativa variabilidad en la prevalencia de la variante de interés ómicron (VOC)”, añadió.
Los NIH recomiendan un ciclo de tres días de remdesivir intravenoso como opción de tratamiento para los pacientes no hospitalizados con COVID-19 leve a moderado que tienen un alto riesgo de enfermedad grave cuando ómicron tiene una prevalencia superior al 80% en una región.
La recomendación se basó en el ensayo PINETREE, que encontró una reducción relativa del 87% en el riesgo de hospitalizaciones y muertes en comparación con el grupo de placebo. Sin embargo, no hubo una diferencia significativa en el perfil de seguridad de ambos grupos, ya que “se produjeron acontecimientos adversos en el 42.3 [por ciento] de los pacientes del grupo de remdesivir y en el 46.3 [por ciento] de los del grupo de placebo”.
El remdesivir está aprobado por la FDA para los pacientes que requieren hospitalización. Los expertos recomiendan a los médicos que realicen “un estrecho seguimiento de los riñones cuando prescriban remdesivir” y que sean conscientes de que el fármaco puede provocar trastornos renales. Además, los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) afirman que todos los pacientes deben someterse a una prueba de la función hepática y a una prueba del tiempo de protrombina (para medir el tiempo que tarda la sangre en coagularse) antes de recibir remdesivir.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.