Se está prestando más atención que nunca a la salud intestinal, y es comprensible, teniendo en cuenta que una parte importante del sistema inmunitario reside en el tracto gastrointestinal. Por ello, optimizar el microbioma intestinal es una tarea que vale la pena y que tendrá efectos de gran alcance en su salud física y bienestar emocional.
La creciente evidencia científica también sigue sugiriendo que un gran componente de la nutrición se centra en nutrir las bacterias que promueven la salud en su intestino (y en otras partes de su cuerpo). De este modo, se mantienen alejados los microbios perjudiciales y se refuerza la protección contra las enfermedades crónicas.
El TDAH, el autismo, los problemas de aprendizaje, la obesidad, la diabetes y la enfermedad de Parkinson son solo algunas de las afecciones en las que influye el microbioma intestinal. Una revisión científica de 2020 publicada en F1000 Research dice que todas las enfermedades inflamatorias comienzan en el intestino. Parte de la culpa la tiene el exceso de higiene. En otras palabras, somos «demasiado limpios» para nuestro propio bien.
Pero la dieta también desempeña un papel crucial. El artículo aborda específicamente el papel de la permeabilidad intestinal mediada por la zonulina en la patogénesis de las enfermedades inflamatorias crónicas (EIC). Según el autor, el Dr. Alessio Fasano, gastroenterólogo pediátrico, investigador y director del Centro de Investigación y Tratamiento de la Celiaquía:
«Los estudios preclínicos y clínicos demuestran que la familia de la zonulina, un grupo de proteínas que modulan la permeabilidad intestinal, está implicada en una variedad de CID, incluyendo enfermedades autoinmunes, infecciosas, metabólicas y tumorales. Estos datos ofrecen nuevas posibilidades terapéuticas para una serie de EPIs en las que la vía de la zonulina está implicada en su patogénesis».
Las bacterias, y no los genes, rigen el destino de su salud
Fasano señala que, sencillamente, no tenemos suficientes genes para explicar la miríada de enfermedades crónicas que pueden acosarnos. Los genes tampoco pueden explicar el momento de aparición de las enfermedades. Para resolver estos misterios, debemos mirar al microbioma, dice, ya que «es la interacción entre nosotros como individuos y el entorno en el que vivimos lo que dicta nuestro destino clínico».
Además de los propios microbios, el estado de la mucosa intestinal también desempeña un papel importante. «Aunque esta enorme interfaz de la mucosa (200 m2) no es aparentemente visible, desempeña un papel fundamental a través de sus interacciones dinámicas con diversos factores procedentes de nuestro entorno, como microorganismos, nutrientes, contaminantes y otros materiales», explica Fasano.
Aunque se pensaba que las uniones estrechas intracelulares eran estáticas e impermeables, ahora sabemos que no es así. Estas uniones, o los espacios entre las células, pueden ensancharse. Cuando lo hacen, las paredes del intestino pueden tener fugas, o volverse permeables. Como explica Fasano, la zonulina es un potente modulador de la permeabilidad intestinal. Sin embargo, aunque la zonulina es un biomarcador de la permeabilidad intestinal y desempeña un papel patogénico en muchas enfermedades inflamatorias crónicas, no todas las EPI están causadas por un intestino permeable.
Propuesta de cadena de acontecimientos que conducen a la enfermedad inflamatoria crónica
El siguiente gráfico, incluido en la revisión de Fasano pero procedente de un artículo anterior titulado «Zonulin, a Regulator of Epithelial and Endothelial Barrier Functions, and Its Involvement in Chronic Inflammatory Diseases» (Zonulina, un regulador de las funciones de la barrera epitelial y endotelial, y su implicación en las enfermedades inflamatorias crónicas), coescrito por Fasano y Craig Sturgeon, detalla la «cadena de acontecimientos propuesta que conduce a la enfermedad inflamatoria crónica».
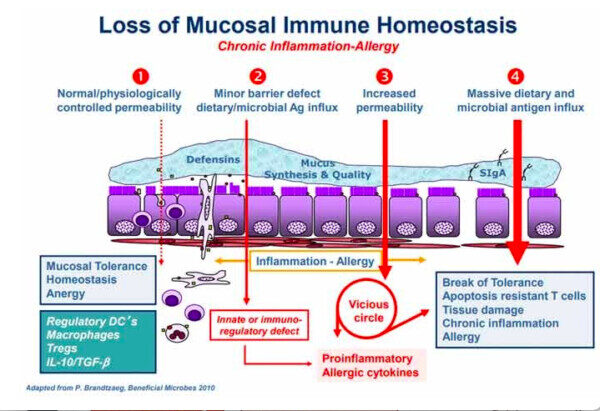
En circunstancias normales, se mantiene una homeostasis saludable en su revestimiento intestinal, de manera que cuando se encuentra un antígeno, no se produce una reacción inmunitaria excesiva (anergia). En el número 2 del gráfico, se está produciendo una disbiosis intestinal (es decir, un desequilibrio en el número y la diversidad de la microflora intestinal), lo que provoca una producción excesiva de zonulina, que a su vez hace que el revestimiento intestinal sea más permeable.
Según Fasano, los dos desencadenantes más potentes de la liberación de zonulina son el crecimiento excesivo de bacterias y el gluten. La zonulina se produce en respuesta a las bacterias malas, ayuda a expulsar las bacterias abriendo las uniones estrechas, por lo que el sobrecrecimiento de bacterias tiene sentido. Pero, ¿por qué responde al gluten?
Curiosamente, la vía de la zonulina interpreta erróneamente el gluten como un componente potencialmente dañino de un microorganismo. Por eso el gluten desencadena la liberación de zonulina. Aunque Fasano no lo menciona, el herbicida glifosato también desencadena la zonulina y, según el Instituto Marion, ¡es 10 veces más potente que el gluten!
La consiguiente permeabilidad permite que el antígeno derivado de la microbiota y la endotoxina migren del lumen a la lámina propia (el tejido conectivo que forma parte de la membrana mucosa que recubre el intestino), desencadenando así la inflamación.
A medida que el proceso se agrava (número 3 del gráfico), la respuesta inmunitaria adaptativa se pone en funcionamiento, desencadenando la producción de citoquinas proinflamatorias, como el interferón gamma (IFN-γ) y el factor de necrosis tumoral alfa (TNF-α). Estas citoquinas empeoran aún más la permeabilidad, y crean así un círculo vicioso. Finalmente (nº 4), la tolerancia de la mucosa se rompe por completo, y da lugar a la aparición de una enfermedad inflamatoria crónica.
Enfermedades inflamatorias crónicas relacionadas con el intestino permeable
La enfermedad inflamatoria crónica específica que finalmente surge al final de todo esto depende en parte de su composición genética, en parte de los tipos de exposiciones que ha tenido, y en parte de la composición de su microbioma intestinal. Como explica Fasano.
«Además de la predisposición genética y la exposición a los desencadenantes ambientales, la patogénesis de una variedad de CIDs parece implicar cambios mutuamente influenciados en la permeabilidad intestinal/tráfico de gérmenes, la activación inmune y los cambios en la composición/función del microbioma intestinal».
«La zonulina es un modulador de las funciones de la barrera epitelial y endotelial. La disbiosis intestinal puede provocar la liberación de zonulina, lo que lleva al paso del contenido luminal a través de la barrera epitelial y provoca la liberación de citoquinas proinflamatorias que, a su vez, causan un aumento de la permeabilidad, establecen un círculo vicioso que conduce a la afluencia masiva de Ags dietéticos y microbianos que desencadenan la activación de las células T».
«Dependiendo de la composición genética del receptor, las células T activadas pueden permanecer dentro del tracto gastrointestinal, causando una IDC del intestino, o migrar a varios órganos diferentes para causar una IDC sistémica».
Las enfermedades inflamatorias crónicas asociadas a la desregulación de la vía de la zonulina incluyen:
- Trastornos autoinmunes como la enfermedad celíaca, la diabetes tipo 1, la enfermedad inflamatoria intestinal, la esclerosis múltiple y la espondilitis anquilosante
- Trastornos metabólicos como la obesidad, la resistencia a la insulina, la enfermedad del hígado graso no alcohólico, la diabetes gestacional, la hiperlipidemia y la diabetes tipo 2
- Enfermedades intestinales como el síndrome del intestino irritable, la sensibilidad al gluten no celíaca y la disfunción entérica ambiental (una enfermedad crónica que afecta al intestino proximal)
- Enfermedades neuroinflamatorias como el trastorno del espectro autista, la esquizofrenia, el trastorno depresivo mayor y la fatiga c rónica/encefalomielitis miálgica
- Cánceres de cerebro e hígado
Los microbios intestinales influyen en los genes y pueden influir en el riesgo de cáncer
Aunque la inclusión del cáncer en esa lista puede parecer extraña a primera vista, algunos investigadores creen que el microbioma intestinal puede acabar siendo un factor de cambio en la prevención y el tratamiento del cáncer.
No solo se ha demostrado que las bacterias intestinales influyen en la expresión genética, al activar algunos genes y desactivar otros, la investigación publicada en 2018 encontró que los microbios intestinales realmente controlan las respuestas inmunes antitumorales en su hígado, y que los antibióticos pueden alterar la composición de las células inmunes en su hígado, desencadenando el crecimiento del tumor.
Ciertas bacterias intestinales también promueven la inflamación, que es un factor subyacente en prácticamente todos los cánceres, mientras que otras bacterias la sofocan. Incluso se demostró que la presencia de ciertas bacterias intestinales potencia la respuesta del paciente a los medicamentos contra el cáncer.
Una de las formas en que las bacterias intestinales mejoran la eficacia del tratamiento del cáncer es activando el sistema inmunitario y permitiendo que funcione con mayor eficacia. De hecho, los investigadores descubrieron que cuando estos microbios específicos están ausentes, ciertos medicamentos contra el cáncer pueden no funcionar en absoluto.
Las bacterias intestinales forman parte de su defensa antiviral
Las bacterias intestinales también participan en su defensa antiviral, según una investigación. Como informó la Escuela de Medicina de Harvard el 18 de noviembre de 2020:
«Por primera vez, los investigadores de la Escuela de Medicina de Harvard identificaron la población específica de microbios intestinales que modula la respuesta inmune localizada y sistémica para alejar a los invasores virales. El trabajo señala un grupo de microbios intestinales, y una especie específica dentro de ellos, que hace que las células inmunitarias liberen sustancias químicas que repelen los virus, conocidas como interferones de tipo 1».
«Los investigadores identificaron además la molécula precisa, compartida por muchas bacterias intestinales dentro de ese grupo, que desencadena la cascada de protección inmunitaria. Esa molécula, señalaron los investigadores, no es difícil de aislar y podría convertirse en la base de fármacos que potencien la inmunidad antiviral en los seres humanos».
Aunque los hallazgos aún deben ser replicados y confirmados, apuntan a la posibilidad de que se pueda mejorar la inmunidad antiviral reproduciendose en el intestino con Bacteroides fragilis y otras bacterias de la familia Bacteroides.
Estas bacterias inician una cadena de señalización que induce la liberación de interferón-beta, lo que protege contra la invasión viral estimulando a las células inmunitarias para que ataquen al virus y hacen que las células infectadas por éste se autodestruyan.
«En concreto, una molécula que reside en la superficie de la bacteria desencadena la liberación de interferón-beta al activar la denominada vía de señalización TLR4-TRIF», explica Harvard, «esta molécula bacteriana estimula una vía de señalización inmunitaria iniciada por uno de los nueve receptores tipo Toll (TLR) que forman parte del sistema inmunitario innato».
El papel de la vitamina D
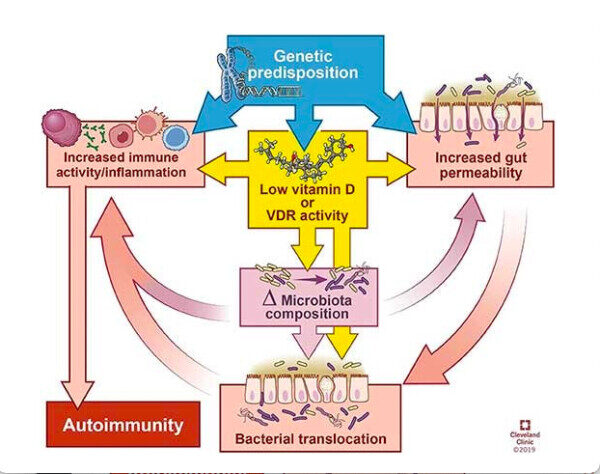
Investigaciones recientes también destacan el papel de la vitamina D en la salud intestinal y la autoinmunidad sistémica. El artículo de revisión, publicado el 21 de enero de 2020 en Frontiers in Immunology, señala:
«Las enfermedades autoinmunes tienden a compartir una predisposición a la deficiencia de vitamina D, que altera el microbioma y la integridad de la barrera epitelial del intestino».
«En esta revisión, resumimos la influencia de las bacterias intestinales en el sistema inmunológico, exploramos los patrones microbianos que surgieron de los estudios sobre enfermedades autoinmunes y discutimos cómo la deficiencia de vitamina D puede contribuir a la autoinmunidad a través de sus efectos en la función de la barrera intestinal, la composición del microbioma y/o los efectos directos en las respuestas inmunes».
Como se señala en esta revisión, escrita por investigadores de la Clínica Cleveland, la vitamina D tiene varios efectos reguladores directos e indirectos sobre el sistema inmunitario, entre ellos la promoción de las células T reguladoras (Tregs), la inhibición de la diferenciación de las células Th1 y Th17, el deterioro del desarrollo y la función de las células B, la reducción de la activación de los monocitos y la estimulación de los péptidos antimicrobianos de las células inmunitarias.
Dicho esto, la relación entre la vitamina D y la autoinmunidad es complicada. Aparte de la inmunosupresión, la vitamina D también parece mejorar los trastornos autoinmunes por la forma en que afecta a la composición de la microbiota y a la barrera intestinal.
La revisión cita investigaciones que demuestran que el estado de la vitamina D altera la composición del microbioma intestinal. En general, la deficiencia de vitamina D tiende a aumentar los Bacteriodetes y las Proteobacterias, mientras que una mayor ingesta de vitamina D tiende a aumentar la prevalencia de Prevotella y a reducir ciertos tipos de Proteobacterias y Firmicutes.
Aunque la investigación es todavía escasa en lo que respecta al impacto de la vitamina D en las bacterias intestinales, especialmente en pacientes con enfermedades autoinmunes, la deficiencia de vitamina D y las enfermedades autoinmunes son comorbilidades conocidas y la suplementación con vitamina D se recomienda a menudo para estos pacientes.
La vitamina D es necesaria para el mantenimiento de las uniones estrechas
Más conocido es el modo en que la vitamina D contribuye a las defensas de las células intestinales e inmunitarias en el intestino. De hecho, la vitamina D es uno de los componentes cruciales necesarios para el mantenimiento de las uniones estrechas. Como se explica en esta revisión:
«El epitelio [tejido] intestinal está en constante interacción con el entorno externo [en forma de alimentos]. La integridad adecuada de la barrera y la función antimicrobiana en las superficies epiteliales son fundamentales para mantener la homeostasis y evitar la invasión o la sobrecolonización de determinadas especies microbianas».
«Un epitelio intestinal sano y una capa de moco intacta son fundamentales para proteger contra la invasión de organismos patógenos, y la vitamina D ayuda a mantener esta función de barrera».
Cómo puede contribuir la vitamina D a las enfermedades autoinmunes
Según los autores, la deficiencia de vitamina D puede contribuir a las enfermedades autoinmunes al afectar al microbioma y al sistema inmunitario de la siguiente manera:
- La deficiencia o la administración de suplementos de vitamina D modifica el microbioma, y la manipulación de la abundancia o la composición bacteriana influye en la manifestación de la enfermedad.
- La falta de señalización de la vitamina D debida a una deficiencia dietética puede deteriorar la integridad de la barrera física y funcional del intestino, permitiendo así que las interacciones bacterianas estimulen o inhiban las respuestas inmunitarias.
- Sus defensas inmunológicas innatas pueden verse comprometidas si tiene una deficiencia de vitamina D.
Cómo optimizar su microbioma intestinal
Toda esta información debería concientizarnos de que optimizar la flora intestinal y el nivel de vitamina D es de crucial importancia para la buena salud. Al restablecer su intestino con bacterias beneficiosas, puede mantener a raya a los microbios y hongos patógenos y evitar que se apoderen de él, y optimizar su vitamina D le ayudará a evitar el intestino permeable.
El consumo regular de alimentos fermentados y cultivados tradicionalmente es la forma más fácil, eficaz y económica de lograr un impacto significativo en el microbioma intestinal. Entre las opciones saludables se encuentran el lassi (una bebida de yogur india), los productos lácteos orgánicos cultivados alimentados con pasto, como el kéfir y el yogur, el natto (soja fermentada) y las verduras fermentadas de todo tipo.
Aunque no soy un gran partidario de tomar muchos suplementos (ya que creo que la mayoría de los nutrientes deben provenir de los alimentos), los probióticos son una excepción si no come alimentos fermentados de forma regular. Los probióticos basados en esporas, o esporobióticos, pueden ser especialmente útiles cuando se toman antibióticos. También son un excelente complemento de los probióticos normales.
Los esporobióticos, que consisten en la pared celular de las esporas del bacilo, ayudarán a reforzar su tolerancia inmunitaria, y como no contienen ninguna cepa viva del bacilo, sino solo sus esporas, la cubierta protectora que rodea el ADN y el mecanismo de funcionamiento de ese ADN, no se ven afectados por los antibióticos.
Los antibióticos, como ya sabrá, matan indiscriminadamente las bacterias del intestino, tanto las buenas como las malas. Por ello, las infecciones secundarias y la disminución de la función inmunitaria son efectos secundarios habituales de la toma de antibióticos. La exposición crónica a dosis bajas de antibióticos a través de los alimentos también afecta al microbioma intestinal, lo que puede provocar una mala salud crónica y un mayor riesgo de resistencia a los medicamentos. Por último, pero no por ello menos importante, hay que evitar las cosas que alteran o matan el microbioma, y esto incluye:
- Antibióticos, a menos que sean absolutamente necesarios
- Carnes y otros productos animales criados convencionalmente, ya que estos animales son alimentados rutinariamente con dosis bajas de antibióticos, además de granos genéticamente modificados y/o tratados con glifosato
- Alimentos procesados (ya que el exceso de azúcares alimenta a las bacterias patógenas)
- Agua clorada y/o fluorada
- Jabón antibacterial y productos que contienen triclosán
El Dr. Joseph Mercola es el fundador de Mercola.com. Médico osteópata, autor de best-sellers y ganador de múltiples premios en el campo de la salud natural, su visión principal es cambiar el paradigma de la salud moderna proporcionando a la gente un recurso valioso para ayudarles a tomar el control de su salud. Este artículo fue publicado originalmente en Mercola.com
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí.
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.





