En esta serie, «Promesa o peligro: Problemas de la vacuna de ARNm contra COVID-19», exploramos cómo la introducción de la tecnología de ARNm careció de un marco normativo adecuado, preparando el escenario para eventos adversos graves y otras preocupaciones relacionadas con las pruebas de seguridad inadecuadas de las nanopartículas lipídicas, la proteína de espiga y las impurezas residuales relacionadas con el ADN y los lípidos, así como las especies de ARNm truncado/modificado.
Anteriormente: En la Parte 1 de esta serie, Es necesaria una revisión de la FDA para las nuevas vacunas y terapias de ARNm, presentamos cómo la FDA relajó las normas para las vacunas de ARNm en comparación con las terapias de ARNm. También hablamos de los datos disponibles sobre la distribución de las nanopartículas lipídicas (NPL) en el organismo basados en ensayos con animales, el hecho de que no se hayan realizado ensayos en humanos y la falta de datos sobre la biodistribución del ARNm o de la proteína de espiga para la vacuna de ARNm contra COVID-19. Pasamos ahora a las implicaciones para la salud de estos compuestos en el organismo.
Resumen de hechos clave:
– Las vacunas de ARNm contra COVID-19 fueron autorizadas para uso humano sin pasar por pruebas completas en animales de los ingredientes activos.
– Los datos de las pruebas en animales, que revisamos en detalle, muestran que el ARNm y la cubierta NPL están presentes en los tejidos en altas concentraciones durante aproximadamente 72 horas, lo que coincide con el momento de las reacciones sistémicas a la vacunación dentro de los primeros dos o tres días.
– Es probable que los lípidos utilizados para crear la cubierta de la NPL permanezcan en el organismo entre cuatro y cinco meses debido a su larga vida media. (pdf)
– Los detalles de los ensayos con animales también muestran elevadas tasas de efectos adversos, como inflamación de las articulaciones y pérdida precoz del embarazo.
– Las autoridades reguladoras conocían estos efectos adversos detectados en animales en enero de 2021. Sin embargo, se permitió que los productos siguieran adelante en humanos, asumiendo que los beneficios superarían los riesgos.
– Los estudios posteriores a la concesión de licencias sobre eventos adversos raros han encontrado evidencia de miocarditis post-vacunación, problemas neurológicos, trombocitopenia (bajo recuento de plaquetas) y coagulación, y un nuevo estudio muestra un fuerte riesgo, dos veces mayor, de pérdida de visión.
Falsas garantías de los CDC
Como ya se comentó en la Parte 1, la Administración de Alimentos y Medicamentos de EE.UU. (FDA) no exigió a Pfizer y Moderna que realizaran pruebas de biodistribución del ARNm activo que codifica la proteína de espiga utilizada en las vacunas. La relajación de las pruebas de biodistribución y farmacocinética de la FDA básicamente aprobó un «huevo de bioingeniería» basado en un examen de la cáscara solamente; en otras palabras, no se probó el contenido.
Los informes proporcionados por Pfizer a las autoridades sanitarias de la FDA (pdf), Australia y Japón (pdf), así como a la Agencia Europea del Medicamento (EMA) (pdf) en enero de 2021 incluyen datos idénticos sobre animales que muestran cómo la nueva cáscara de la NPL se desplaza por el organismo. Los informes también muestran cómo se utilizó un ARNm sustituto («falso») (que codifica para la luciferasa) para visualizar por dónde viaja el ARNm.
Aunque el compuesto luciferasa tiene un nombre siniestro, es una enzima inofensiva que se encuentra en las luciérnagas y en otras partes de la naturaleza, y es bioluminiscente, es decir, brilla en la oscuridad. Así pues, la luciferasa es útil para visualizar compuestos biológicos en tejidos animales.
Estos informes muestran una amplia dispersión del caparazón de la NPL. Los CDC dieron falsas garantías sobre la duración de la actividad biológica y la distribución basándose en escasos datos sobre animales y ningún dato humano sobre biodistribución. La gente confió en estas afirmaciones como si fueran verdad. Así, la agencia difundió tranquilizaciones vagas y engañosas cuando en ese momento se disponía de datos que contradecían estas afirmaciones.
Aunque la página web original de los CDC, ahora solo disponible a través de archivos web, contenía un mensaje que afirmaba que el ARNm se descompone en cuestión de días y que la proteína de espiga no persiste en el cuerpo más allá de unas pocas semanas, simplemente no disponíamos de estos datos, lo que presumiblemente les llevó a eliminar la referencia de duración resaltada.
Para entender las implicaciones para la salud de la nueva tecnología de vacunas de ARNm, primero debemos examinar dónde viajan la luciferasa, la proteína de espiga y las PRL en el cuerpo y cuánto tiempo persisten.
¿Qué ocurre con la luciferasa «que brilla en la oscuridad»?
La Agencia Europea de Medicamentos (EMA) es el equivalente de la FDA en la Unión Europea. El informe de la EMA (pdf) nos da más detalles sobre los estudios en animales que muestran por dónde viajan la luciferasa y el caparazón de NPL, así como las concentraciones de estos compuestos en los tejidos inmediatamente después de la vacunación.
Pfizer llevó a cabo un estudio en el que se utilizaron dos métodos -bioluminiscencia y radiactividad- para marcar el ARNm de la luciferasa y la cubierta de la NPL con radiactividad.
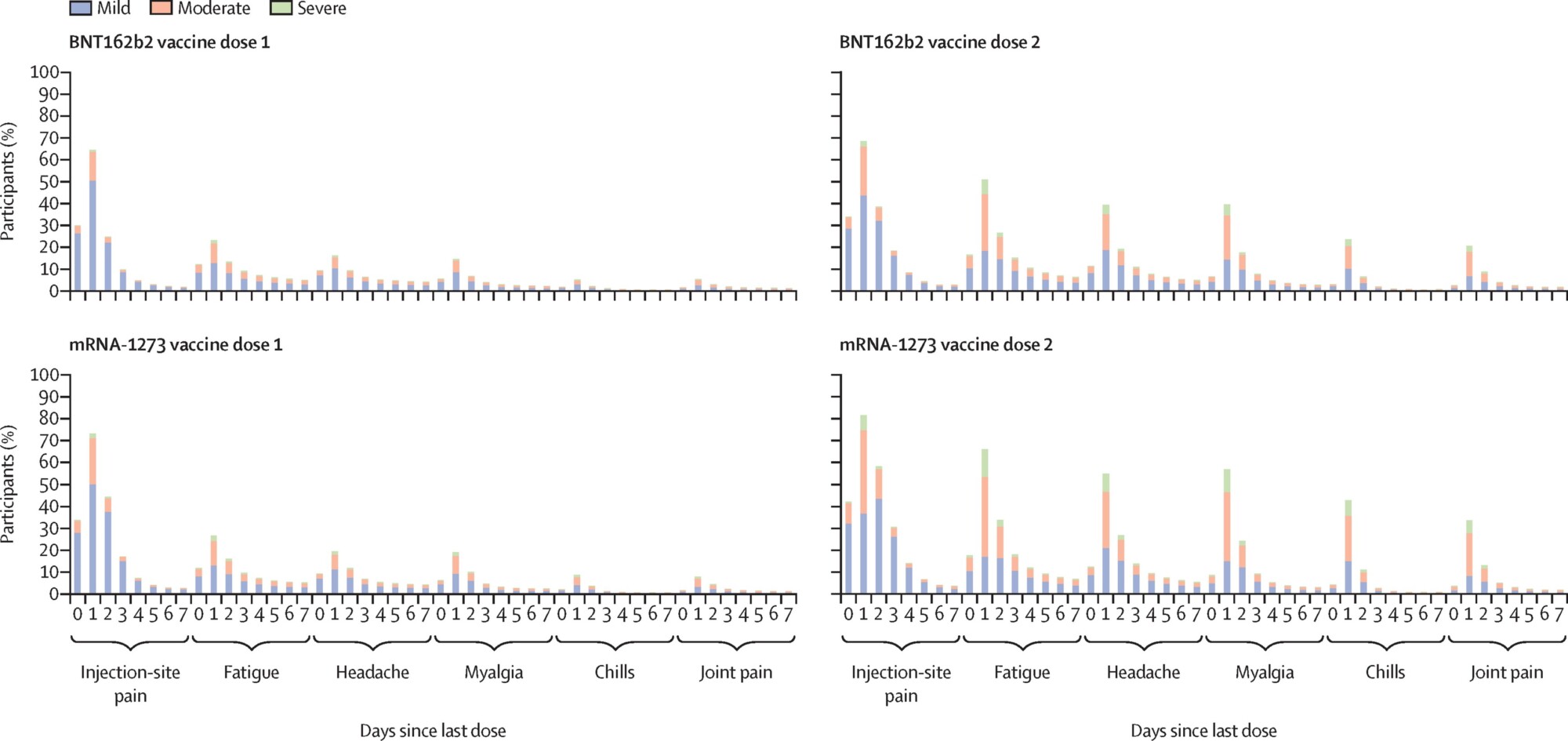
Las señales del ARNm de la luciferasa alcanzaron su punto máximo en el lugar de la inyección a las seis horas, 10,000 veces más que en los animales de control. También se detectó actividad de luciferasa en los ganglios linfáticos y el hígado. A continuación, la señal disminuyó lentamente a lo largo de 72 horas. (página 46) Los niveles siguieron disminuyendo y, al noveno día, el nivel de luciferasa en los animales experimentales era siete veces superior al encontrado en los animales de control. No se tomaron medidas adicionales después del noveno día. Esta elevada actividad de la luciferasa en las primeras 72 horas se correlaciona con los síntomas adversos que pueden experimentar las personas tras la vacunación.
El estudio de radiactividad de la cáscara de la NPL encontró los niveles más altos en la mayoría de los tejidos entre ocho y 48 horas después de la inyección. La mayor parte de la NPL se concentraba en el hígado. El informe continúa describiendo cuánto tiempo permanecen los lípidos en el hígado. Uno de los lípidos (ALC-0315) puede permanecer en el hígado de cuatro a cinco meses cuando los datos se extrapolan a los humanos. (páginas 53-54)
En conjunto, estos dos estudios en animales demuestran que el ARNm y la cubierta de la NPL pueden encontrarse en los tejidos en concentraciones máximas en un plazo de 72 horas.
Figura 1. Reacciones adversas a la vacunación por días desde la última dosis
¿Qué ocurre con la proteína de espiga?
Una vez que la NPL de la vacuna entra en nuestras células y libera el ARNm, se produce la proteína de espiga y se despliega en la superficie de nuestras células. El código del ARNm contiene instrucciones para fabricar la proteína de espiga completa, que contiene dos subunidades (S1 y S2). El sistema inmunitario ve que estas células muestran la proteína de espiga y responde como si el virus hubiera infectado la célula.
Cuando estas células son destruidas por el sistema inmunitario, se producen anticuerpos que se unen a la proteína espiga. Sin embargo, la proteína espiga, incluida su subunidad S1, puede liberarse en la sangre durante este desordenado proceso de digestión celular por el sistema inmunitario.
La circulación de la proteína de espiga en la sangre puede explicar algunos acontecimientos adversos graves, como la miocarditis y otros acontecimientos adversos, incluidos los raros problemas neurológicos que resultan de la infección por COVID-19, así como de la vacunación con BNT162b2 y mRNA-1273.
Por ejemplo, un estudio publicado en Circulation señala que «se detectaron niveles marcadamente elevados de proteína de espiga de longitud completa (33.9±22.4 pg/mL), no unida por anticuerpos, en el plasma de individuos con miocarditis postvacunal, mientras que no se detectó espiga libre en sujetos de control vacunados asintomáticos (prueba t no apareada; P<0.0001).» En otras palabras, la proteína de espiga libre puede proporcionar una pista sobre por qué algunos jóvenes desarrollan miocarditis tras la vacunación.
Este estudio sugirió que la diferencia no estaba causada por anticuerpos neutralizantes en el grupo de miocarditis, sino que probablemente se debía a una inmunidad innata hiperactiva. En otras palabras, tener demasiados anticuerpos no era la causa de la miocarditis. Los autores sospechan que podría estar implicado otro componente del sistema inmunitario, la inmunidad innata.
La inmunidad innata es la que ayuda al organismo a combatir las infecciones, incluso la primera vez que ve un nuevo virus o bacteria. Estos «defensores iniciales» innatos (citocinas inflamatorias) no necesitan entrenamiento para identificar a los invasores extraños. Una respuesta innata hiperactiva se asocia a las alergias y también puede ser lo que desencadena la miocarditis.
Por el contrario, algunos autores han planteado la hipótesis de que la supresión de la respuesta inmunitaria innata natural podría explicar algunos efectos adversos de la vacuna de ARNm contra COVID-19.
Dado que el ARNm activo y la proteína de espiga que codifica nunca se probaron en animales ni en cultivos de tejidos vivos, no había forma de predecir estos problemas. Esencialmente, la FDA permitió que se autorizara un producto sin suficientes pruebas preclínicas de toxicidad.
¿Es tóxica la cubierta de nanopartículas lipídicas?
Como reitera la EMA, «No se han realizado estudios farmacocinéticos o de biodistribución tradicionales con la vacuna candidata BNT162b2». (página 45) Los estudios de biodistribución son importantes porque, como continúa la EMA, «ALC-0315 y ALC-0159 son excipientes nuevos, no utilizados previamente en un producto acabado aprobado en la UE». Estos dos nuevos «excipientes» (ALC-0315 y ALC-0159) son las nanopartículas lipídicas utilizadas para crear la cubierta de la NPL. Se trata de compuestos nuevos, diferentes de los ya existentes en compuestos PEGilados utilizados en una amplia variedad de medicamentos inyectados.
El informe de la EMA afirma además que la semivida del lípido ALC-0315 es bastante larga. (página 46) El término semivida significa la cantidad de tiempo que tarda en eliminarse la mitad del compuesto. En la página 54, el informe de la EMA aclara que cabe esperar que la mitad del ALC-0315 se elimine del cuerpo humano en unos 20 o 30 días, y que el 95 por ciento se elimine en cuatro o cinco meses.
En otro resumen de deliberación (pdf) de la Oficina de Seguridad Farmacéutica y Salud Medioambiental del gobierno japonés (febrero de 2021) se revisaron todos los datos antes de tomar una decisión sobre la autorización. El informe mostraba efectos en el hígado que «se consideraban de escasa importancia toxicológica». (página 20) Sin embargo, el informe también señala que «no se ha evaluado la toxicidad a largo plazo de dosis repetidas de Comirnaty» y, por lo tanto, el régimen de dosificación debe ser limitado, y el uso de lípidos en la vacuna no debe considerarse un precedente. En otras palabras, aunque los compuestos PEGylated se han utilizado en medicina durante años, existe información limitada sobre su uso como parte de una NPL portadora de una vacuna, por lo que no hay datos existentes que respalden dosis repetidas, como refuerzos, más allá de la serie primaria original.
La EMA estuvo de acuerdo: «Esta vacuna [BNT162b2] contiene dos componentes nuevos (el lípido catiónico ALC-0315 y el líquido PEGilado ALC-0159) en la NPL, para los que existe una experiencia limitada». Dada la larga vida media del lípido ALC-0315 y la toxicidad del PEG-lípido ALC-0159, la EMA reconoció que si bien no hay preocupaciones inmediatas y obvias para el uso humano, también hay datos muy limitados y la «evidencia actual no es definitiva».
«En cuanto a la toxicidad relacionada con el PEG, que se sabe que depende de la dosis, la frecuencia de la dosis, la duración del tratamiento y el peso molecular de la proteína PEG, no se espera que la inmunogenicidad sea un problema debido al bajo peso molecular de este PEG (<2KDa). Los datos científicos disponibles en esta fase no suscitan preocupaciones notables en cuanto a la inmunogenicidad o inmunotoxicidad del PEG, pero las pruebas actuales no son definitivas». (página 134)
La EMA señala que los acontecimientos adversos graves fueron dos veces más frecuentes en el grupo de la vacuna (21 por ciento) que en el grupo placebo (13 por ciento). La frecuencia fue baja en general (<1 por ciento), pero los siguientes acontecimientos adversos de sistema/órgano/clase fueron los más frecuentemente notificados: «Trastornos generales y afecciones en el lugar de administración» (11.9 por ciento frente a 2.9 por ciento), «reacciones musculoesqueléticas» (5.5 por ciento frente a 2.1 por ciento) y «trastornos del sistema nervioso» (4.2 por ciento frente a 2.1 por ciento).
Dado que en estos estudios con animales no se analizó el principio activo (ARNm que codifica la proteína de la espiga), es probable que estos resultados se refieran a la inmunotoxicidad de la propia cubierta de la PNL. No obstante, la EMA llegó a la conclusión de que los beneficios globales eran lo suficientemente positivos como para seguir adelante, dada la protección ofrecida a los ancianos y a las personas con comorbilidades.
El informe de la EMA señala inflamación y abortos espontáneos
En estudios de toxicidad con dosis repetidas en ratas a las que se administró una dosis semanal durante tres semanas, se observó inflamación de las articulaciones y los ganglios linfáticos, así como cambios en la médula ósea. (página 49)
En las pruebas de toxicidad reproductiva (página 50), el informe afirma: «Hubo un aumento (~2x) de la pérdida preimplantacional (9.77 por ciento, comparado con el control 4.09 por ciento) aunque esto estaba dentro del rango histórico de datos de control (5.1-11.5 por ciento)». En otras palabras, aunque la tasa de abortos espontáneos fue el doble en los animales vacunados que en los de control, la tasa estaba dentro de lo esperado según estudios anteriores. Los mismos datos figuran en la página 55 del informe australiano.
Curiosamente, el candidato BNT162b1 -uno de los dos candidatos a vacuna de Pfizer que codificaba solo el dominio de unión al receptor, no la espiga completa- tenía una tasa de pérdida preimplantacional mucho menor (4.8 por ciento) que la vacuna que finalmente se comercializó. El segundo modelo (BNT162b2) se eligió para uso global porque tenía menos efectos secundarios.
Algunos tipos de pérdida de visión se correlacionan con la vacunación
Un nuevo estudio en Nature confirma una «fuerte correlación entre la vacunación con una vacuna de ARNm y la oclusión vascular retiniana». La retina es la parte del ojo que recibe la luz y la convierte en señales nerviosas que se traducen en visión en el cerebro. La retina está cubierta de diminutos vasos sanguíneos, y cuando éstos se ocluyen (bloquean) debido a una mala salud cardiovascular o a la diabetes, se pierde la visión. La obstrucción de los vasos puede deberse a hinchazón, espasmos, flujo sanguíneo deficiente en los vasos y tromboembolismo (coagulación). La infección por SARS-CoV-2 también está relacionada con la oclusión de la retina.
Dada la creciente evidencia de que la vacunación causa oclusión, este estudio utilizó los historiales médicos de aproximadamente 6 millones de personas para explorar la asociación a largo plazo entre vacunación y oclusión. Los autores emparejaron a 745,041 personas vacunadas y a 3,874,458 no vacunadas, lo que dio como resultado un grupo de comparación final de más de 500,000 individuos en cada grupo.
Los investigadores encontraron 415 casos entre las personas vacunadas de 18 a 64 años y 1108 casos entre las vacunadas de 65 años o más. Esto representaba un riesgo más de tres veces mayor de oclusión retiniana tras la vacunación en un plazo de 12 semanas y un riesgo más de dos veces mayor hasta dos años después en comparación con los no vacunados. No hubo diferencias en el riesgo entre las marcas de vacunas de ARNm (Pfizer frente a Moderna) y el riesgo fue elevado tras las dosis uno y dos. El riesgo fue mayor durante las dos primeras semanas y persistió durante 12 semanas. El riesgo fue igualmente elevado en hombres y mujeres, así como en función de la raza o etnia.
Los autores del estudio conjeturan que la similitud entre las proteínas de espiga y las proteínas humanas puede causar el bloqueo.
En resumen, estos informes plantean muchas cuestiones preocupantes que abordamos en esta serie.
1. La cápsula de NPL se dispersa por todo el cuerpo, principalmente hacia el hígado. ¿Se deshace o permanece en forma de cápsula? ¿Cuánto tiempo permanece la cápsula de NPL en el organismo? ¿Está relacionada la respuesta inmunitaria a la NPL con la ceguera posvacunal?
2. La NPL también puede atravesar la barrera hematoencefálica (BHE), al igual que la subunidad S1 de la proteína de espiga del SARS-CoV-2 (en ratones). ¿Qué implicaciones tiene el hecho de que las subunidades NPÑ y S1 atraviesen la BBB?
3. La nanopartícula lipídica ALC-0315 tiene una vida media larga (unas seis semanas en el hígado). ¿Se elimina el 95 por ciento del lípido del cuerpo humano en cuatro o cinco meses, como se espera?
4. La EMA afirma que se conoce la inmunotoxicidad asociada al polietilenglicol (PEG) (página 134). Esta es la primera vez que el PEG-lípido ALC-0159 se ha utilizado como componente de una vacuna en humanos. ¿Qué respuesta inmunitaria provoca el PEG-lípido ALC-0159?
5. ¿Cuánto tiempo persiste el ARNm en el organismo? ¿Permanece en la cápsula hasta que se libera en las células? ¿Se desprende de la cápsula de NPL? ¿Qué problemas puede causar el ARNm si circula por el torrente sanguíneo? (Serie Parte 3)
6. Se ha encontrado proteína de espiga libre en pacientes con miocarditis, pero no en los controles. ¿Cuánto tiempo permanece la proteína de espiga en el organismo? ¿Hacia dónde viaja? ¿Cómo puede la proteína de espiga o su subunidad S1 causar miocarditis u otros acontecimientos adversos que pueden incluir problemas neurológicos? (Serie Parte 4)
7. El informe de la EMA también señalaba impurezas en las dosis de vacuna producidas mediante el proceso de fabricación comercial que no se encontraron en los viales utilizados en los ensayos clínicos. Estas impurezas incluyen fragmentos de ARN que pueden codificar proteínas inesperadas, causando potencialmente reacciones adversas, incluyendo reacciones alérgicas, que discutiremos más adelante en esta serie. Estas últimas muestran un extraño predominio en las mujeres, lo que plantea la necesidad de una evaluación de riesgos adaptada a otro parámetro. (Serie Parte 5)
8. ¿Qué está causando efectos en los nervios periféricos como la parálisis de Bell? ¿Cuáles son las últimas investigaciones que describen efectos adversos neurológicos, cardíacos, autoinmunes y reproductivos? ¿Hay algo que la gente pueda hacer para reducir el riesgo de un futuro acontecimiento adverso?
Los acontecimientos adversos señalados por la EMA en enero de 2021 sugieren que antes de autorizar estos productos deberían haberse realizado ensayos más exhaustivos con animales y estudios adicionales de biodistribución y seguridad en humanos. Además, el informe de la EMA señalaba que se habían encontrado diferencias en los lotes. Se solicitaron informes adicionales al fabricante. ¿Dónde está la comunicación pública relativa a las actualizaciones sobre estas cuestiones? ¿Por qué la FDA no aplicó normas más estrictas de «terapia genética» de ARNm a la regulación de las vacunas de ARNm? En otras palabras, ¿por qué se dio un pase especial a las vacunas cuando utilizaban la misma plataforma tecnológica?
Se podrían haber realizado los estudios requeridos incluso dentro del plazo de tiempo comprimido. Además, dadas las enormes ganancias que estos productos han cosechado gracias a su distribución mundial, ¿por qué no se aceleran los estudios posteriores a la comercialización? Como último ejemplo de este retraso en el marco normativo, la vigilancia posterior a la comercialización solicitada por la FDA no exige la presentación de informes sobre la incidencia y el curso natural de la miocarditis vacunal hasta septiembre de 2024.
A continuación: Analizaremos el diseño de las NPL en la Parte 3 e investigaremos cómo su diseño podría predisponerlas a agruparse o deshacerse, dos factores que pueden provocar la coagulación.
◊ Referencias
Addgene. Molecular Biology Reference.
Alana F Ogata, Chi-An Cheng, Michaël Desjardins, Yasmeen Senussi, Amy C Sherman, Megan Powell, Lewis Novack, Salena Von, Xiaofang Li, Lindsey R Baden, David R Walt, Circulating Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients, Clinical Infectious Diseases, Volumen 74, Número 4, 15 Febrero 2022, Pags. 715–718.
Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y. Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 mRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line. Curr Issues Mol Biol. 2022 Feb 25;44(3):1115-1126. doi: 10.3390/cimb44030073. PMID: 35723296; PMCID: PMC8946961.
Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine—Estados Unidos, Diciembre 14–23, 2020. MMWR Morb Mortal Wkly Rep 2021;70:46–51. DOI.
Anderson EJ, Rouphael NG, Widge AT, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults N Engl J Med 2020; 383:2427-2438.
Anderson S. CBER Plans for Monitoring COVID-19 Vaccine Safety and Effectiveness. Octubre 20, 2020. Acceso 3/20/23.
Angeli F, Spanevello A, Reboldi G, Visca D, Verdecchia P. SARS-CoV-2 vaccines: Lights and Shadows. Eur J Intern Med. 2021 Junio;88:1-8. doi: 10.1016/j.ejim.2021.04.019. Epub 2021 Apr 30. PMID: 33966930; PMCID: PMC8084611.
Baker, A. T., Boyd, R. J., Sarkar, D., Teijeira-Crespo, A., Chan, C. K., Bates, E., Waraich, K., Vant, J., Wilson, E., Truong, C. D., Lipka-Lloyd, M., Fromme, P., Vermaas, J., Williams, D., Machiesky, L., Heurich, M., Nagalo, B. M., Coughlan, L., Umlauf, S., Chiu, P. L., … Borad, M. J. (2021). ChAdOx1 interacts with CAR and PF4 with implications for thrombosis with thrombocytopenia syndrome. Science Advances. 7(49), eabl8213.
Baumeier C, Aleshcheva G, Harms D, Gross U, Hamm C, Assmus B, Westenfeld R, Kelm M, Rammos S, Wenzel P, Münzel T, Elsässer A, Gailani M, Perings C, Bourakkadi A, Flesch M, Kempf T, Bauersachs J, Escher F, Schultheiss H-P. Intramyocardial Inflammation after COVID-19 Vaccination: An Endomyocardial Biopsy-Proven Case Series. International Journal of Molecular Sciences. 2022; 23(13):6940.
Bloom, K., van den Berg, F. & Arbuthnot, P. Self-amplifying RNA vaccines for infectious diseases. Gene Ther 28, 117–129 (2021).
Chauhan, H., Mohapatra, S., Munt, D.J. et al. Physical-Chemical Characterization and Formulation Considerations for Solid Lipid Nanoparticles. AAPS PharmSciTech 17, 640–651 (2016).
Chui CSL, Fan M, Wan EYF, et al. Thromboembolic events and hemorrhagic stroke after mRNA (BNT162b2) and inactivated (CoronaVac) covid-19 vaccination: A self-controlled case series study. Lancet. 2022;(50).
Dag Berild J, Bergstad Larsen V, Myrup Thiesson E, et al. Analysis of Thromboembolic and Thrombocytopenic Events After the AZD1222, BNT162b2, and MRNA-1273 COVID-19 Vaccines in 3 Nordic Countries. JAMA Netw Open. 2022;5(6):e2217375. doi:10.1001/jamanetworkopen.2022.17375.
daSilva RL. Viral-associated thrombotic microangiopathies. Hematology/Oncology and Stem Cell Therapy. 2011:4(2):51-59.
De A, Ko YT. Why mRNA-ionizable LNPs formulations are so short-lived: causes and way-out. Expert Opin Drug Deliv. 2023 Feb;20(2):175-187. doi: 10.1080/17425247.2023.2162876. Epub 2023 Jan 1. PMID: 36588456.
Ehaideb, S.N., Abdullah, M.L., Abuyassin, B. et al. Evidence of a wide gap between COVID-19 in humans and animal models: a systematic review. Crit Care 24, 594 (2020).
European Medicines Agency Assessment Report Comirnaty (pdf)
Faizullin D, Valiullina Y, Salnikov V, Zuev Y. Direct interaction of fibrinogen with lipid microparticles modulates clotting kinetics and clot structure. Nanomedicine. 2020 Jan;23:102098. doi: 10.1016/j.nano.2019.102098. Epub 2019 Oct 23. PMID: 31655206.
FDA. Considerations for Human Radiolabeled Mass Balance Studies—Guidance for Industry. Mayo, 2022.
FDA. Development and Licensure of Vaccines to Prevent COVID-19.
FDA-CBER-2021-5683-0013962 approved on: 09-Nov-2020. A Tissue Distribution Study of a [3H]-Labeled Lipid Nanoparticle-mRNA Formulation Containing ALC-0315 and ALC-0159 Following Intramuscular Administration in Wistar Han Rats. (pdf) FINAL REPORT Test Facility Study No. 185350 Sponsor Reference No. ALC-NC-0552.
Fertig TE, Chitoiu L, Marta DS, Ionescu VS, Cismasiu VB, Radu E, Angheluta G, Dobre M, Serbanescu A, Hinescu ME, Gherghiceanu M. Vaccine mRNA Can Be Detected in Blood at 15 Days Post-Vaccination. Biomedicines. 2022 Junio 28;10(7):1538. doi: 10.3390/biomedicines10071538. PMID: 35884842; PMCID: PMC9313234.
Grobbelaar LM et al. SARS-CoV-2 spike protein S1 induces fibrin(ogen) resistant to fibrinolysis: implications for microclot formation in COVID-19 Biosci Rep (2021) 41 (8): BSR20210611.
Hou, X., Zaks, T., Langer, R. et al. Lipid nanoparticles for mRNA delivery. Nat Rev Mater 6, 1078–1094 (2021).
Iaboni A, Jindal N, Betschel SD, Song C. Second-dose mRNA COVID-19 vaccine safety in patients with immediate reactions after the first dose: A case series. Journal of Allergy and Clinical Immunology: Global. 2022;1(3): 172-174.
Let’s talk about lipid nanoparticles. Nat Rev Mater 6, 99 (2021).
Li, JX., Wang, YH., Bair, H. et al. Risk assessment of retinal vascular occlusion after COVID-19 vaccination. npj Vaccines 8, 64 (2023).
Michieletto, D., Lusic, M., Marenduzzo, D. et al. Physical principles of retroviral integration in the human genome. Nat Commun 10, 575 (2019).
Moghimi, S. M., & Simberg, D. (2022). Pro-inflammatory concerns with lipid nanoparticles. Molecular therapy: The Journal of the American Society of Gene Therapy, 30(6), 2109–2110.
Naturally Inspired Podcast. Jessica Rose Ph.D.—VAERS, Data And Truth
Ohlson J. Plasmid manufacture is the bottleneck of the genetic medicine revolution. Drug Discov Today. 2020 Oct 16;25(11):1891–3. doi: 10.1016/j.drudis.2020.09.040. Epub ahead of print. PMID: 33075470; PMCID: PMC7564888.
Perico L, Marina Morigi M, Galbusera M, et al. SARS-CoV-2 Spike Protein 1 Activates Microvascular Endothelial Cells and Complement System Leading to Platelet Aggregation. Front. Immunol. 2022
Qin, S., Tang, X., Chen, Y. et al. mRNA-based therapeutics: powerful and versatile tools to combat diseases. Sig Transduct Target Ther 7, 166 (2022).
Rafati A, Pasebani Y, Jameie M, et al. Association of SARS-CoV-2 Vaccination or Infection With Bell Palsy: A Systematic Review and Meta-analysis. JAMA Otolaryngol Head Neck Surg. Publicado en línea Abril 27, 2023. doi:10.1001/jamaoto.2023.0160
Rhea EM, Logsdon AF, Hansen KM, Williams LM, Reed MJ, Baumann KK, Holden SJ, Raber J, Banks WA, Erickson MA. The S1 protein of SARS-CoV-2 crosses the blood-brain barrier in mice. Nat Neurosci. 2021 Mar;24(3):368-378. doi: 10.1038/s41593-020-00771-8. Epub 2020 Dec 16. PMID: 33328624; PMCID: PMC8793077.
Röltgen K, Nielsen SCA, Silva O. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell 2022;185(6):1025-1040.
Rosenblum HG, Gee J, Liu R, et al. Safety of mRNA vaccines administered during the initial 6 months of the US COVID-19 vaccination programme: an observational study of reports to the Vaccine Adverse Event Reporting System and v-safe. Lancet Infectious Diseases. 2022;22(6):802-812.
Schmeling, M, Manniche, V, Hansen, PR. Batch-dependent safety of the BNT162b2 mRNA COVID-19 vaccine. Eur J Clin Invest. 2023; 00:e13998. doi:10.1111/eci.13998
Srinivasan M, Thangaraj SR, Arzoun H. Gene Therapy – Can it Cure Type 1 Diabetes? Cureus. 2021 Dec 19;13(12):e20516. doi: 10.7759/cureus.20516. PMID: 35004071; PMCID: PMC8723777.
Trougakos IP, Terpos E, Alexopoulos H, et al. Adverse effects of COVID-19 mRNA vaccines: the spike hypothesis. Cell 2022;28(7): P542-554.
Vervaeke P, Borgos SE, Sanders NN, Combes F. Regulatory guidelines and preclinical tools to study the biodistribution of RNA therapeutics. Adv Drug Deliv Rev. 2022 May;184:114236. doi: 10.1016/j.addr.2022.114236. Epub 2022 Mar 26. PMID: 35351470; PMCID: PMC8957368.
Wong DWL, Klinkhammer BM, Djudjaj S, Villwock S, Timm MC, Buhl EM, Wucherpfennig S, Cacchi C, Braunschweig T, Knüchel-Clarke R, Jonigk D, Werlein C, Bülow RD, Dahl E, von Stillfried S, Boor P. Multisystemic Cellular Tropism of SARS-CoV-2 in Autopsies of COVID-19 Patients. Cells. 2021 Jul 27;10(8):1900. doi: 10.3390/cells10081900. PMID: 34440669; PMCID: PMC8394956.
Yonker LM, Swank Z, Bartsch YC, et al. Circulating Spike Protein Detected in Post–COVID-19 mRNA Vaccine Myocarditis. Circulation. 2023:147(11).
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.