La vacuna contra COVID-19 de Pfizer contiene fragmentos de ARNm llamados «ARNm truncado». Este es un problema grave que se suma a los eventos de seguridad potencialmente mortales de la vacuna. Sorprendentemente, Pfizer presentó informes analíticos de ARNm falsificados a múltiples autoridades sanitarias.
La cuestión del ARNm truncado llevó a la Agencia Europea del Medicamento (EMA) a plantear una «objeción importante» antes de su aprobación condicional de la vacuna en diciembre de 2020. ¿Qué ha ocurrido? ¿Cómo se han considerado resueltas estas cuestiones? Este artículo de la serie en dos partes abordará el asunto en profundidad y examinará sus posibles consecuencias para la salud humana.
Resumen de los hechos clave
– La vacuna contra COVID-19 de Pfizer contiene ARNm truncado, lo que la EMA señaló como motivo de su «objeción mayor», indicando la exclusión de su aprobación.
– Pfizer no ha investigado los resultados perjudiciales del ARNm truncado en sus vacunas.
– Pfizer presentó a la Administración de Alimentos y Medicamentos (FDA) y a la EMA cifras de Western blot generadas digitalmente, no de experimentos reales.
– Ha habido una alarmante falta de acción por parte de las autoridades sanitarias en este asunto.
– El ARNm truncado contribuye potencialmente a múltiples lesiones relacionadas con las vacunas, incluyendo coágulos sanguíneos fibrosos inducidos por la proteína de espiga mal plegada, trastornos autoinmunes y cáncer.
– Estos problemas con la vacuna de Pfizer podrían haber dado lugar a variaciones drásticas en la calidad del producto de un lote a otro. Esto podría explicar la diferencia en los acontecimientos adversos experimentados por los receptores de la vacuna.
– La raíz de esta conducta irresponsable de las autoridades farmacéuticas y sanitarias es la falta de ética.
Cuando uno va a un supermercado y quiere comprar 10 botellas de leche entera para sus hijos, suele suponer que las sustancias químicas y las concentraciones de esas 10 botellas son las mismas o similares. Nadie esperaría que cinco de las botellas estuvieran llenas de leche aguada mientras que las otras cinco estuvieran llenas de yogur.
La mayoría de los alimentos comprados en tiendas cumplen nuestras expectativas gracias a la normativa y al control de calidad. Los mismos criterios existen también en la industria farmacéutica, incluidos los productos vacunales.
Esperamos que los parámetros físicos y químicos de los ingredientes clave sean los mismos en los distintos lotes de medicamentos o vacunas. La coherencia es la base que permite a pacientes y consumidores confiar en la seguridad y eficacia de los medicamentos.
El proceso CMC -abreviatura de química, fabricación y controles- implica la definición de prácticas de fabricación y especificaciones de producto que deben seguirse para garantizar la seguridad del producto y la coherencia entre lotes. Se trata de un criterio obligatorio para que las autoridades sanitarias mundiales aprueben un medicamento o vacuna.
Controlar la calidad de un producto químico tradicional es relativamente sencillo, pero en el caso de un producto biológico, como un ARNm, las cosas se complican.
¿Qué es el ARNm truncado? ¿Por qué es importante?
Nuestro ADN contiene códigos genéticos compuestos de nucleótidos. El ADN produce proteínas formadas por aminoácidos. Entre el código genético y la proteína hay una molécula puente, un «traductor», llamada ARN mensajero (ARNm).
La secuencia completa de ARNm de la vacuna de Pfizer que codifica la proteína de espiga tiene una longitud de 4284 nucleótidos.
Consta de una estructura 5′ CAP para preparar su traducción en una proteína de espiga. Funciona como la caja de encendido de un coche. Al final de la región traducible, el marco de lectura abierto, hay un codón de parada, que es como los frenos de un coche. Si un ARNm truncado no contiene un codón de parada, no emite una señal de «freno». El proceso de traducción de la proteína continuará sin fin.
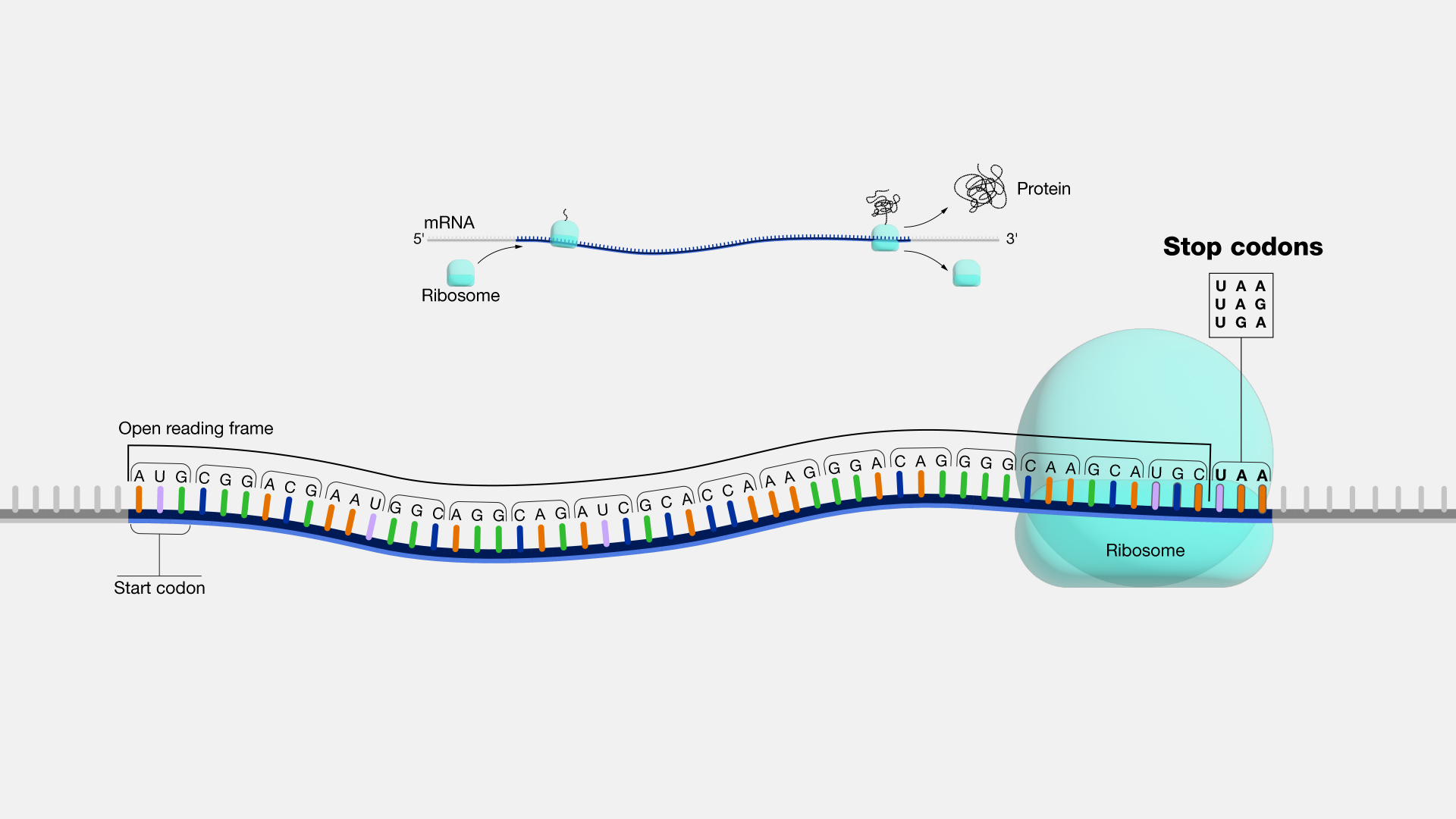
La falta de un codón de parada en un ARNm truncado es muy perjudicial para el ser humano. Puede dar lugar a la producción de proteínas tóxicas.
La vacuna contra COVID-19 de Pfizer contiene ARNm truncado
La EMA es responsable de aprobar todos los medicamentos de uso humano en Europa, incluidos los fármacos y las vacunas. El Comité de Medicamentos de Uso Humano (CHMP) es el comité de la EMA encargado de interpretar los dictámenes de la agencia.
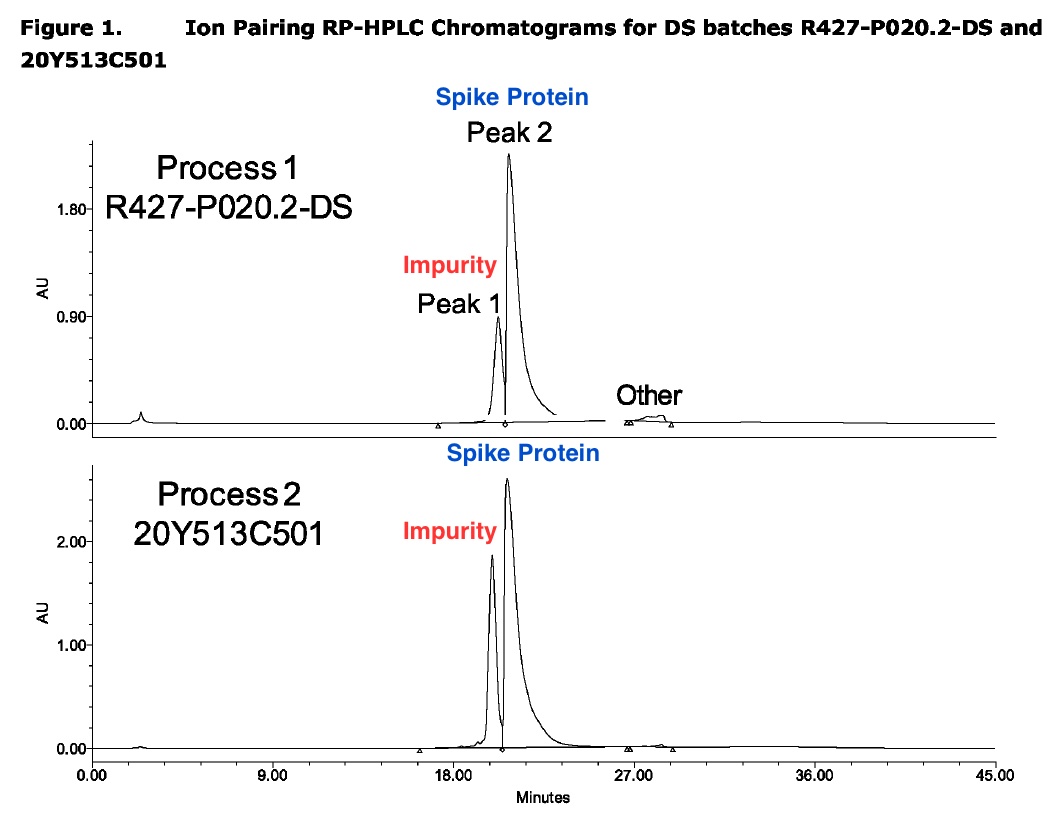
En un informe de evaluación de la EMA con el código EMA/CHMP/448917/2021, la EMA pidió a Pfizer que abordara las impurezas de su producto vacunal, que el informe de la EMA describía como «ARNm truncado y modificado».
El informe de Pfizer a la EMA mostró claramente que la vacuna de Pfizer contenía impurezas, como se indica en el «Pico 1» en el gráfico a continuación, basado en una captura de pantalla de la página 14 del informe de agosto de 2021 de la EMA.
La EMA exigió a Pfizer que proporcionara datos mensuales sobre el potencial de generar proteínas/péptidos de espiga truncados u otras proteínas/péptidos que causen afecciones autoinmunes debido a mecanismos de mimetismo molecular. Se fijó como fecha límite julio de 2021, y debería haberse presentado un informe provisional en marzo de 2021.
La EMA marcó el ARNm truncado como «objeción mayor»
En un informe de evaluación de la EMA sobre «Comirnaty, vacuna de ARNm COVID-19 (modificado con nucleósidos)», codificado como EMA/707383/2020, con fecha de 19 de febrero de 2021, en la página 15, en la sección «Fabricante, controles del proceso y caracterización», se afirma que «Durante el procedimiento, se destacaron varias cuestiones relacionadas con el estado de las BPF de la fabricación de la sustancia activa y los lugares de prueba del producto terminado a efectos de la liberación de lotes. Estas cuestiones se clasificaron como objeción mayor (MO)».
Una «objeción mayor» es una alerta roja reglamentaria formal de la EMA. Si las objeciones mayores siguen sin resolverse, impiden la concesión de la autorización de comercialización.

El ARNm truncado ha sido ampliamente discutido como una «Objeción Mayor» planteada por la EMA en los dos informes de la EMA que hemos analizado anteriormente. Antes de que estos agentes biológicos se desplegaran en la población mundial, los revisores de la EMA identificaron el problema del ARNm truncado y lo plantearon como una «objeción mayor».
En junio de 2022, Trial Site News publicó un informe de investigación que revelaba una diapositiva filtrada presentada en una reunión entre Pfizer-BioNTech y la EMA. Alexandra (Sasha) Latypova, una antigua ejecutiva de la industria farmacéutica que ha trabajado con muchas empresas, incluida Pfizer, compartió la misma diapositiva en su Substack el 10 de enero de 2023.
La EMA exigió a Pfizer que solucionara estos problemas: «Las formas truncadas deben estar suficientemente caracterizadas, es decir, deben describirse, y debe discutirse si se espera que las especies fragmentadas sean similares entre lotes. Además, debe abordarse la posibilidad de que se traduzcan proteínas distintas de la proteína de espiga prevista (S1S2), resultantes de especies de ARNm truncadas y/o modificadas, y deben facilitarse los datos pertinentes de caracterización de proteínas, si se dispone de ellos.»

Pfizer reconoció el ARNm truncado en sus vacunas
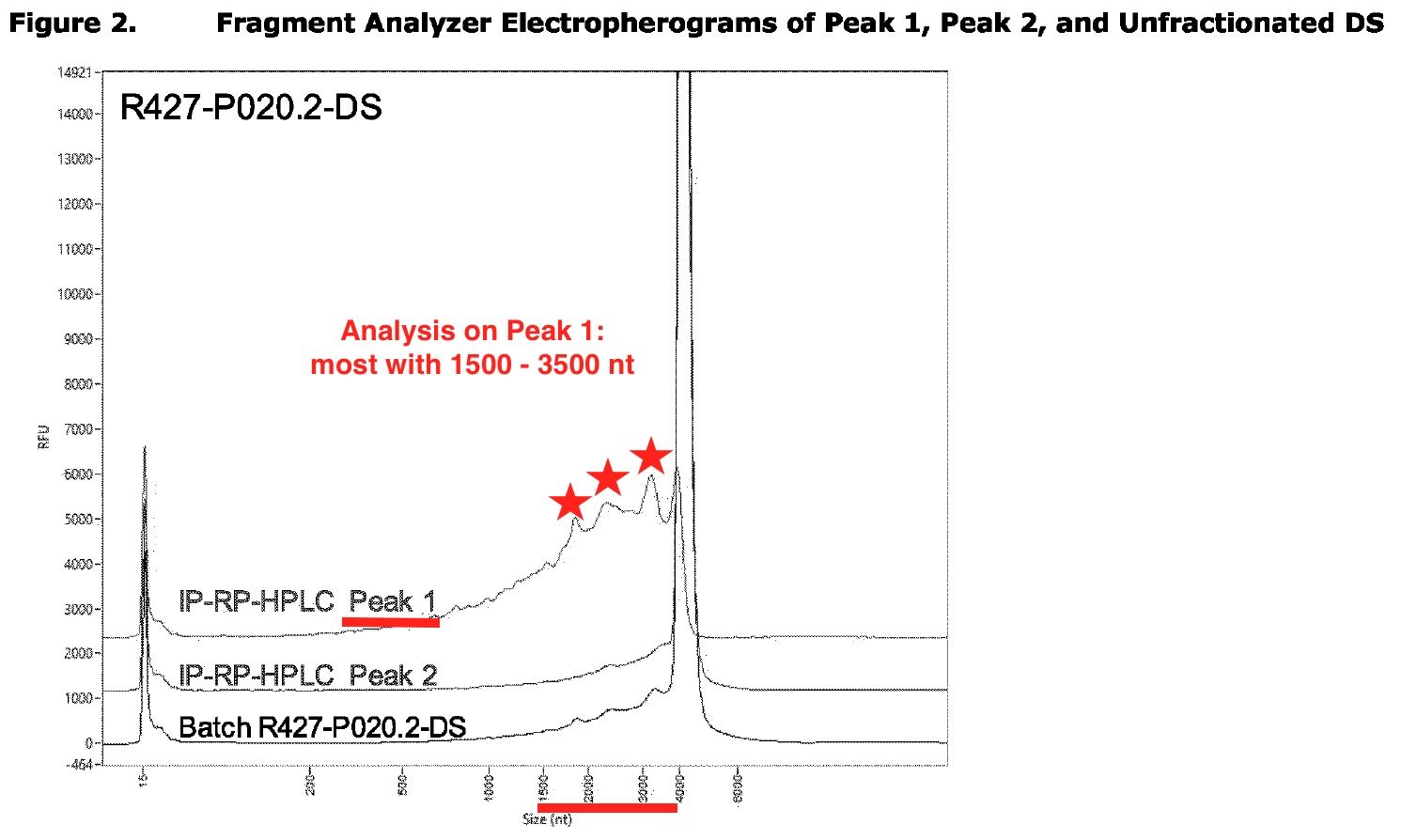
Pfizer reconoció plenamente el ARNm truncado en sus vacunas. La mayoría de los ARNm truncados tienen una longitud de 1500 a 3500 nucleótidos con 5′ CAP, les falta la cola Poly(A) y el codón de parada. Pueden traducirse en una proteína de espiga parcial.
Desgraciadamente, cuando el ARNm llega al final de la traducción, la cadena de aminoácidos no deja de prolongarse, ya que no se les ha dado ninguna señal de parada. Hay muchos ARNm en la célula. Como no hay señal de parada, en teoría, otro ARNm de la célula tomará el relevo y continuará el trabajo inacabado, prolongando la «proteína de espiga».
Si el mismo ARNm de espiga toma el relevo, se formarán proteínas prolongadas similares a la espiga con múltiples repeticiones. Si toma el relevo un ARNm diferente, se crearán tipos desconocidos de proteínas.
El gráfico anotado a continuación se basa en una captura de pantalla de la página 15 del informe de la EMA de agosto de 2021.
Pfizer también admitió que al ARNm truncado le faltaba una cola Poly(A). El gráfico anotado a continuación se basa en una captura de pantalla de la página 17 del informe de la EMA de agosto de 2021.
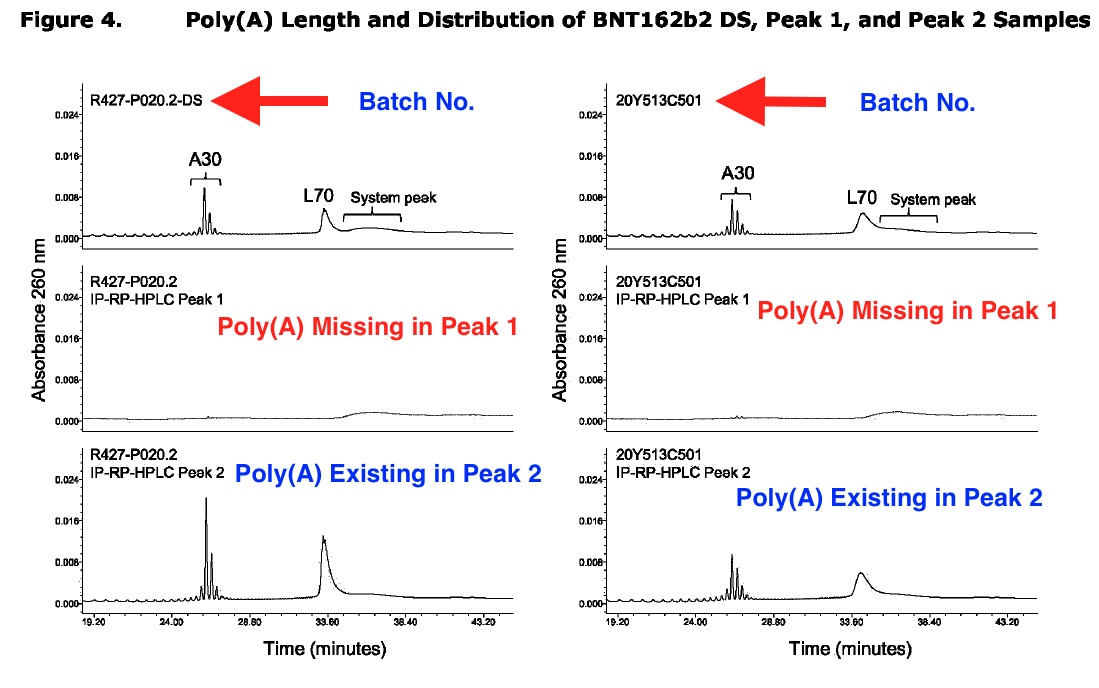
Llamativamente, la proporción precisa de impurezas del pico 1 estaba tachada en este informe descargado de la EMA.
La tabla anotada a continuación se basa en una captura de pantalla de la página 17 del mismo informe de la EMA.

Pfizer presentó cifras digitalizadas de Western Blot a la FDA y la EMA
El método «Western blot» se utiliza para identificar proteínas específicas, lo que permite a los investigadores verificar el tamaño y la abundancia de una proteína de interés.
Debido a la preocupación de que una proteína de espiga incorrecta pueda causar lesiones inesperadas, la EMA exigió a Pfizer-BioNTech que presentara resultados experimentales para demostrar que el ARN truncado de la vacuna COVID-19 no produciría proteínas de fragmento.
La petición de la EMA es una preocupación básica y mínima que debe abordarse para cualquier producto de ARNm destinado al uso humano.
Sin embargo, dado que este es el primer caso de uso de ARNm como vacuna preventiva para una gran población, también es la primera vez que surge un problema de calidad de este tipo. No estamos seguros de si existía previamente alguna norma de calidad reguladora para gestionar el riesgo de los ARNm truncados.
La única forma de caracterizar estos fragmentos de ARN es mediante secuenciación. Pfizer no ha comunicado la secuencia detallada de sus ARNm truncados en su informe, solo el número aproximado de nucleótidos.
En diciembre de 2020, Pfizer proporcionó a la FDA imágenes de Western blots que expresaban los niveles de proteínas de espiga inducidas por la vacuna contra COVID-19 y afirmó que la vacuna no producía ninguna otra proteína.
A continuación se muestra una figura de ejemplo generada por Pfizer, basada en una captura de pantalla de la página 39 de un informe de la FDA de 2020. Pfizer declaró que había evaluado el tamaño de la proteína expresada por la vacuna de ARNm y concluyó: «El tamaño de la proteína expresada es coherente con el tamaño esperado de la sustancia de la vacuna de ARNm traducido y comparable en todos los lotes probados».
Sin embargo, el gráfico parece digital o informatizado. Explicaremos la razón de nuestra valoración más adelante en este artículo.

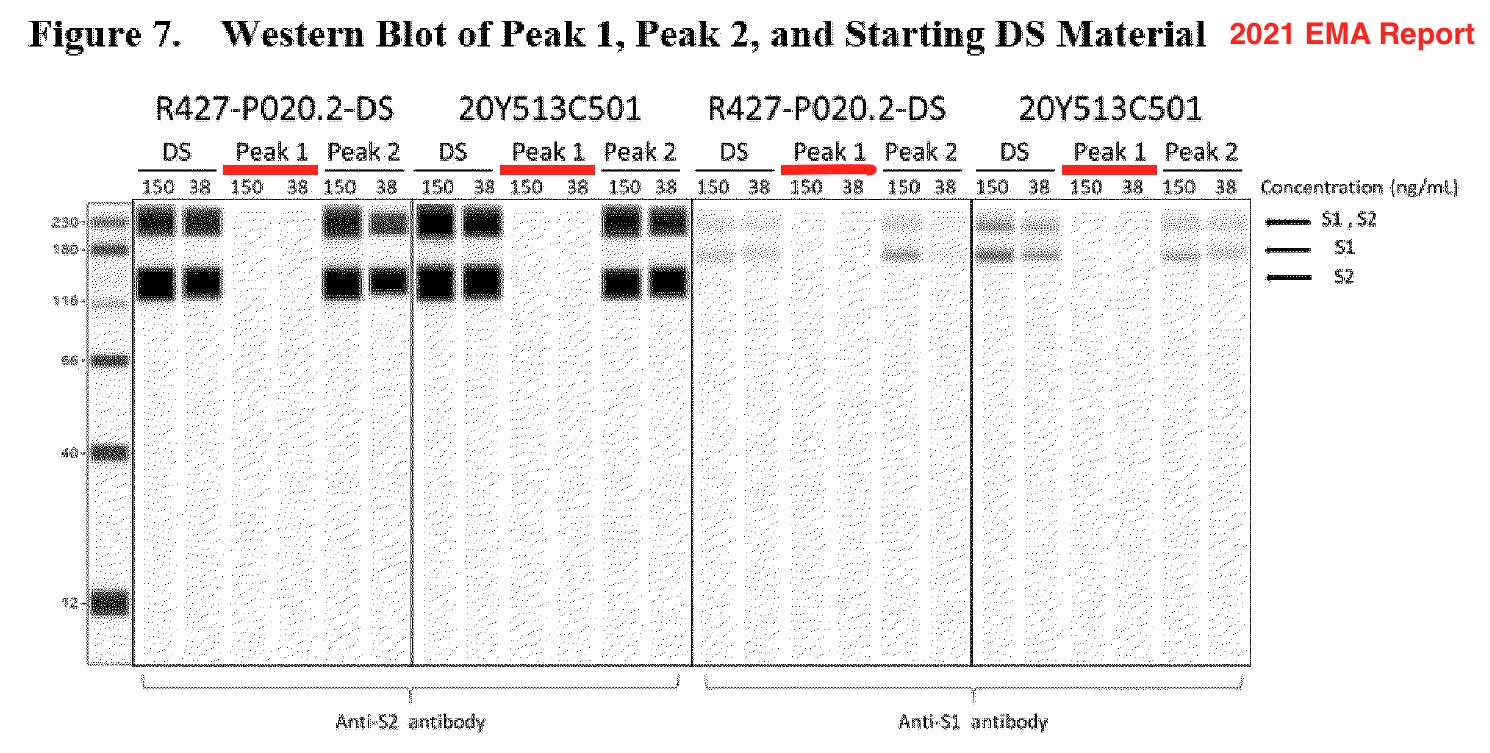
A continuación se ofrecen otros tres ejemplos de Western blots presentados en 2021 por Pfizer a la EMA.
Un Western blot mostró que el ARNm truncado en el pico 1 no genera proteínas in vitro. La figura anotada a continuación se basa en una captura de pantalla de la página 19 del informe de la EMA. Sin embargo, los Western blots son resultados digitales o informatizados similares a los presentados en diciembre de 2020.
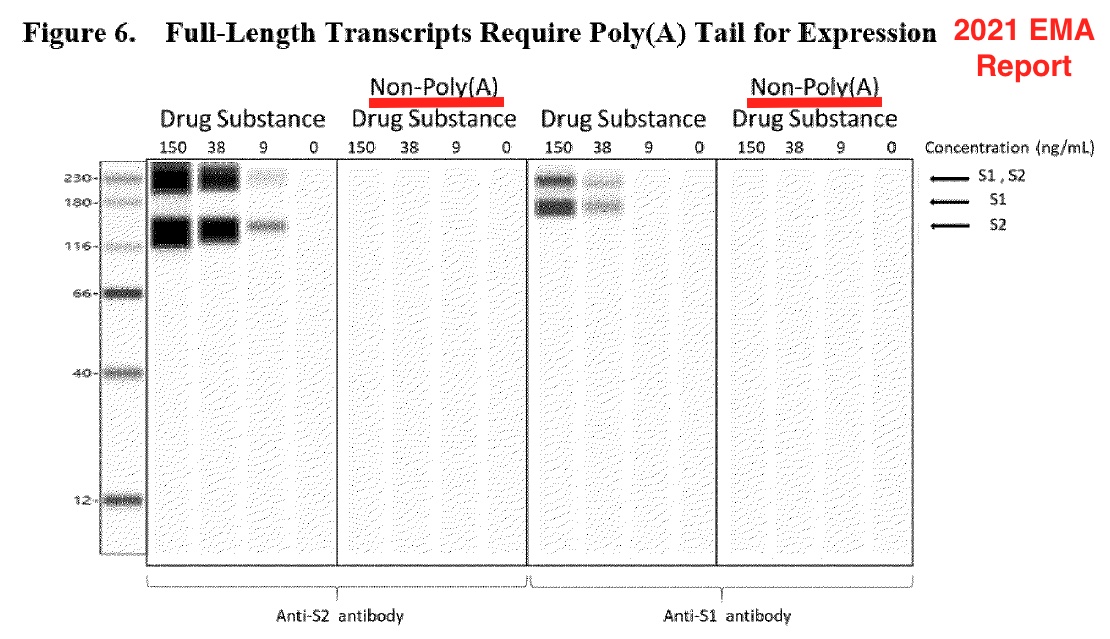
Pfizer utilizó los dos gráficos siguientes para explicar que los transcritos de longitud completa requieren Poly(A) para su expresión; sin embargo, los Western blots son resultados informatizados. La figura anotada a continuación se basa en capturas de pantalla de la página 18 del informe de agosto de 2021 de la EMA.

Los Western blots falsos de Pfizer se enviaron a agencias reguladoras de todo el mundo, incluidas al menos la FDA, la EMA y la Administración de Productos Terapéuticos de Australia (TGA).
¿Cómo sabemos que estos Western Blots no son reales?
El primer paso de la técnica Western blot consiste en separar las proteínas de una muestra mediante un proceso de biología molecular llamado «electroforesis en gel».
Como las distintas proteínas tienen tamaños y pesos moleculares diferentes, cuando se las pone en el mismo campo eléctrico, correrán a velocidades diferentes de un polo al otro, como en una carrera.
En el punto de partida, las proteínas están juntas en una línea, como en una carrera de 400 metros. Dado un cierto tiempo, las proteínas más pequeñas van más rápido que las más grandes, y poco a poco, las diferentes proteínas se separarán en diferentes lugares, llamados «bandas». Esto es similar a lo que ocurre en una carrera de atletismo: los distintos corredores se separarán uno tras otro en función de su velocidad en una carrera de 400 metros.
Entre los factores que determinan el aspecto de los Western blots se encuentran la velocidad de transferencia de proteínas, el tiempo de incubación y la concentración de anticuerpos.
Como resultado, en la vida real, los Western blots rara vez son perfectos; siempre hay algunas distorsiones.
Los Western blots suelen «sonreír» (curvarse hacia arriba en los bordes) un poco, sangrar con cola y tener bordes redondeados y barras desiguales. Esto suele deberse a la presencia de sal en las muestras o a una alta concentración de proteínas con carga eléctrica, lo que modifica la intensidad del campo eléctrico en sus proximidades y afecta a su migración.
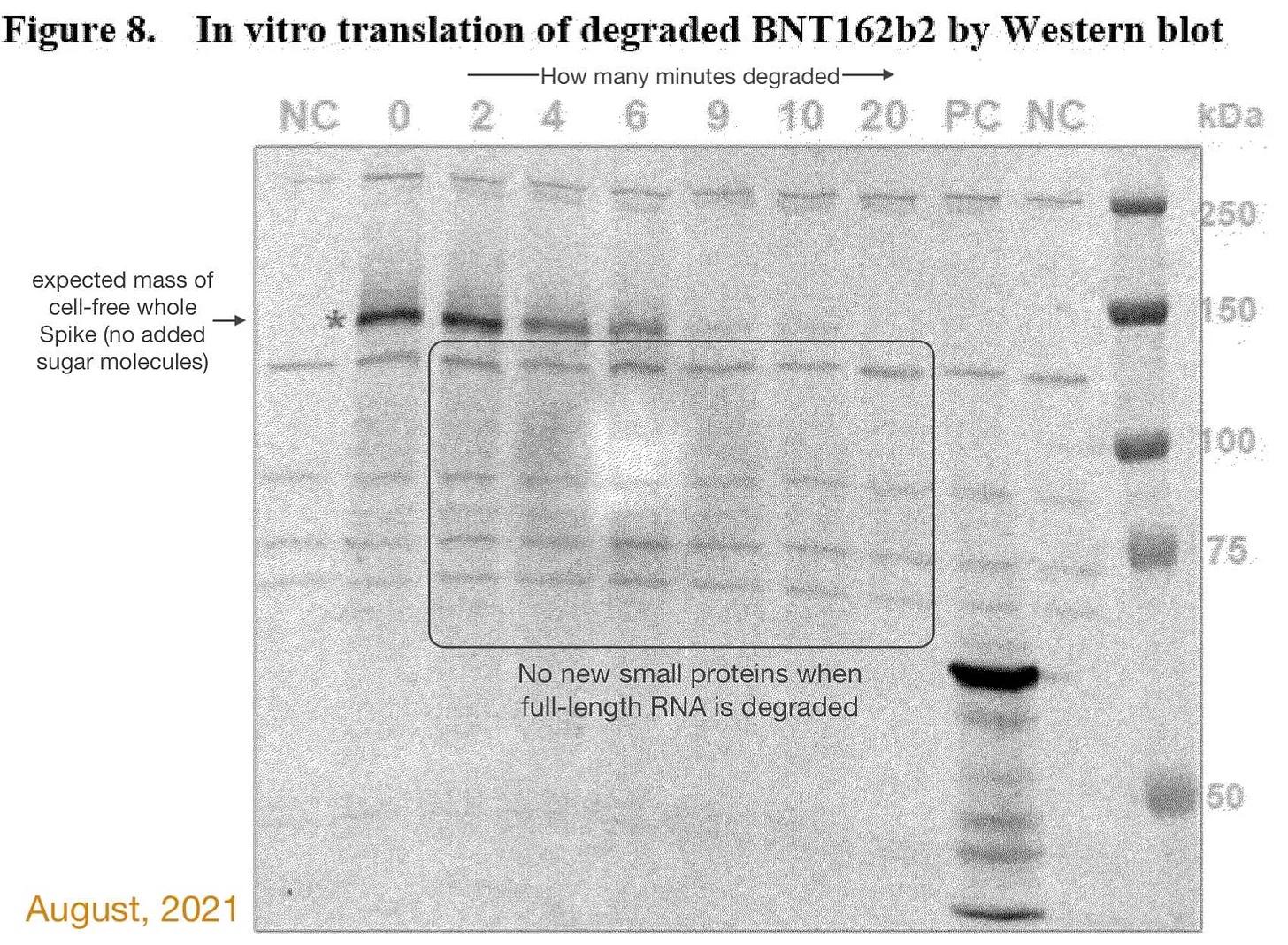
Por ejemplo, el gráfico de Western blot (abajo) del informe de la EMA de 2021 parece proceder de un experimento real. Un artefacto común, como una burbuja de aire entre el gel y la membrana del blot, probablemente causó el punto claro cerca del centro de la Fig. 8 durante el experimento real. Las zonas más claras y más oscuras son comunes.
Este es el único gráfico de Western blot del informe de la EMA que parecía proceder de un experimento «real». Sin embargo, Pfizer no explica por qué presentó dos conjuntos de gráficos Western blot a la EMA en el mismo informe sobre el mismo asunto.
Muchos de los Western blots proporcionados por Pfizer-BioNTech para sus proteínas de espiga inducidas por la vacuna COVID-19 parecían impecablemente limpios y perfectamente rectangulares.
Los tres Western blots (figuras 5, 6 y 7) citados anteriormente parecen falsamente perfectamente regulares, con todas las bandas permaneciendo bien en su carril; los blots están totalmente libres de ruido.
El Epoch Times se puso en contacto con Pfizer para obtener sus comentarios.
La falta de datos experimentales no permite una conclusión definitiva; sin embargo, la EMA lo aprobó
En el mismo informe, la EMA también escribió: «Es probable que las especies fragmentadas no den lugar a proteínas expresadas, debido a su previsible poca estabilidad y escasa eficacia traslacional (véase más adelante). Sin embargo, la falta de datos experimentales sobre el ARN truncado y las proteínas expresadas no permiten llegar a una conclusión definitiva y necesitan una mayor caracterización. Por lo tanto, quedan por aportar datos de caracterización adicionales como obligación específica (SO1).»
¿Alguien interpretaría informes falsos como datos experimentales fiables y confiaría en ellos para respaldar la aprobación reglamentaria?

No obstante, en las páginas 22 y 23 del informe de la EMA de agosto de 2021, la EMA afirmaba que estas cuestiones se consideraban resueltas. ¿Cómo se consideran resueltos? ¿Se basó esta decisión en esos falsos Western blots?
La EMA concedió a Pfizer/BioNTech la autorización condicional de comercialización el 12 de diciembre de 2020.
En la Parte 2 de esta serie, continuaremos analizando las implicaciones de este problema de calidad y el resultado potencial de las lesiones relacionadas con las vacunas.
Agradecimientos: Gracias al Dr. Joe Wang por su revisión y comentarios sobre este artículo.
Los artículos de Epoch Health tienen fines informativos y no sustituyen el asesoramiento médico individualizado.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.