Los pacientes con cáncer de melanoma y tumores sólidos pueden recurrir a un nuevo tratamiento gracias a la aprobación de una nueva clase de inmunoterapia por parte de la Administración de Alimentos y Medicamentos de EE. UU. (FDA). El nuevo tratamiento puede ofrecer esperanza a quienes se enfrentan a una etapa de la enfermedad que de otro modo sería mortal.
Amtagvi (lifileucel) es la primera terapia con linfocitos infiltrantes de tumores (LIT) que sale al mercado. La FDA otorgó el viernes la aprobación acelerada a la compañía Iovance Biotherapeutics para el uso del medicamento en el tratamiento de pacientes con melanoma avanzado que no se puede extirpar con cirugía o que se ha extendido a otras partes del cuerpo.
«La aprobación de Amtagvi da esperanza a quienes con melanoma avanzado no mejoraron con tratamientos estándar iniciales, dado que muchas opciones actuales no funcionan para todos los pacientes», dijo Samantha R. Guild, presidenta de AIM at Melanoma Foundation, en un comunicado de prensa. «Esta terapia celular única representa una innovación prometedora para la comunidad afectada por melanoma, por eso estamos entusiasmados con su potencial para transformar la atención a los pacientes que necesitan urgentemente opciones terapéuticas adicionales».
«El melanoma no extirpable o metastásico es una forma agresiva de cáncer que puede ser mortal», dijo el Dr. Peter Marks, director del Centro de Evaluación e Investigación Biológica (CBER) de la FDA, en un comunicado de prensa de la agencia. «La aprobación de Amtagvi representa la culminación de los esfuerzos de investigación científica y clínica que conducen a una nueva inmunoterapia con células T para pacientes con pocas opciones de tratamiento».
Amtagvi utiliza las células T del paciente para combatir el cáncer
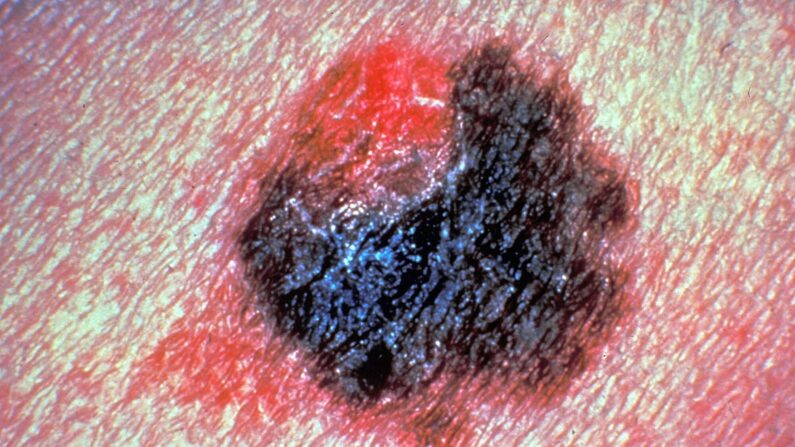
El melanoma es un tipo de cáncer cutáneo que se inicia en las células que dan color a la piel, los melanocitos. A menudo comienza en la piel que está expuesta regularmente a la luz solar, como los brazos, la espalda, la cara y las piernas. Si bien las causas exactas no están claras, la mayoría de las investigaciones señalan que la exposición a la luz ultravioleta es el factor principal.
Si bien comienza en la piel, el cáncer puede extenderse a los ganglios linfáticos y otras partes del cuerpo. Según la Sociedad Estadounidense del Cáncer, aproximadamente una de cada 33 personas de raza blanca lo desarrollará, mientras que una de cada 1000 personas de raza negra y una de cada 200 hispanas lo padecerán.
El tratamiento es adecuado para pacientes que han probado otras formas de terapia, como inhibidores bloqueadores de PD-1 o medicamentos dirigidos al gen BRAF. Los inhibidores bloqueadores de PD-1 utilizan anticuerpos para atacar proteínas específicas del cuerpo y ayudar al sistema inmunológico a combatir las células cancerosas. Los medicamentos contra el gen BRAF ayudan a controlar el crecimiento y la función de determinadas células asociadas al cáncer de piel. Según la FDA, estas terapias tienen cierto éxito en pacientes con melanoma, pero para aquellos cuyo cáncer ha progresado, hubo una «necesidad médica no cubierta» hasta la aprobación de Amtagvi.
Amtagvi utiliza las células T del paciente, unas células inmunitarias que combaten el cáncer. Para crear la terapia, se extirpa una parte del tumor canceroso del paciente mediante una intervención quirúrgica. Las células T se separan del tumor y se devuelven al paciente por medio de una infusión única. Aunque existen otras terapias, esta es la primera inmunoterapia de células T derivadas del tumor y aprobada por la FDA.
«El melanoma es un cáncer potencialmente mortal que puede causar impactos devastadores en las personas afectadas, con un riesgo significativo de diseminarse y extenderse a otras áreas del cuerpo», dijo en el comunicado de prensa publicado el viernes. «La aprobación de hoy refleja la dedicación y el compromiso de la FDA con el desarrollo de alternativas terapéuticas innovadoras, seguras y eficaces para los pacientes con cáncer».
Amtagvi fue aprobado después de que un estudio clínico de 73 pacientes revisara su perfil de seguridad y eficacia. Según la FDA, entre los participantes tratados con el nuevo medicamento, el 31.5 por ciento vieron reducción en sus tumores. La terapia tiene efectos secundarios, que incluyen un recuento sanguíneo bajo, grave y prolongado, una infección grave, un trastorno cardiaco y la posibilidad de desarrollar un empeoramiento de la función respiratoria o renal. La terapia viene con un recuadro de advertencia sobre estos riesgos, señaló la FDA. Otras reacciones comunes incluyen escalofríos, fiebre, fatiga, frecuencia cardíaca acelerada, diarrea, hinchazón, sarpullido, presión arterial baja, caída del cabello, infección, niveles bajos de oxígeno y dificultad para respirar.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo clic aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.