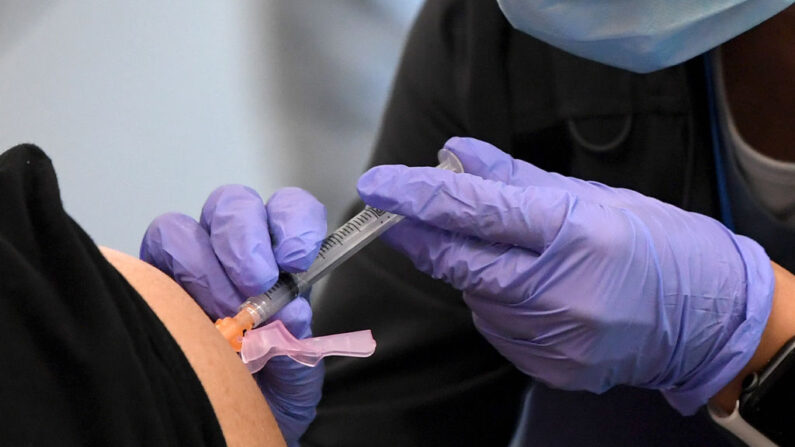
Regeneron anunció el viernes que la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) autoriza una dosis más baja de su tratamiento contra el virus del PCCh para que sea inyectable.
La aprobación se produce como una actualización de la autorización de uso de emergencia (EUA) de la FDA para el cóctel de anticuerpos de la compañía para tratar el COVID-19, la enfermedad causada por el virus del PCCh (Partido Comunista Chino). El tratamiento está disponible en virtud de la EUA desde el pasado mes de noviembre para las personas recientemente diagnosticadas con COVID-19.
La FDA había autorizado en noviembre una dosis de 2400 mg del cóctel de anticuerpos REGEN-COV —una combinación de los anticuerpos monoclonales casirivimab e imdevimab— para ser administrada como dosis única directamente inyectada en una vena para pacientes de COVID-19 no hospitalizados.
Como parte de la EUA actualizada, REGEN-COV está aprobado para inyección «cuando la infusión intravenosa no es factible y conduciría a un retraso en el tratamiento».
La nueva dosis autorizada tanto para inyección como para infusión intravenosa sería de 1200 mg (600 mg de casirivimab y 600 mg de imdevimab), la mitad de la dosis autorizada originalmente. La medida significa que ahora habrá más dosis disponibles para los pacientes dentro del contrato de la empresa con el gobierno estadounidense.
Regeneron anunció recientemente que su ensayo de fase 3 demostró que su medicamento reducía el riesgo de hospitalización o muerte en un 70% en pacientes de alto riesgo con síntomas leves o moderados de COVID-19. El ensayo también demostró que el efecto del tratamiento era consistente entre las dosis de 1,200 mg y 2,400 mg.
La autorización actualizada (pdf) permite combinar el fármaco en un único vial inyectable, aunque puede seguir administrándose mediante viales individuales separados.
«A pesar del aumento del uso de las vacunas, miles de pacientes siguen infectándose en Estados Unidos cada día, y muchos de ellos corren un alto riesgo de sufrir complicaciones graves a causa del COVID-19», afirmó George Yancopoulos, presidente y director científico de Regeneron, en un comunicado. «Lamentablemente, hasta la fecha solo una fracción de los pacientes elegibles para los tratamientos con anticuerpos los han recibido, lo que esperamos que cambie a partir de esta autorización actualizada de la FDA».
«REGEN-COV está fácilmente disponible y es suministrado gratuitamente por el gobierno de Estados Unidos», añadió. «REGEN-COV también ha demostrado su eficacia contra las principales variantes de interés hasta la fecha in vitro y es la única terapia de anticuerpos actualmente disponible en todo Estados Unidos, incluso en los estados en los que las variantes identificadas por primera vez en Brasil y Sudáfrica están circulando a una tasa más alta».
Según el Wall Street Journal, la terapia de Regeneron ha sido infrautilizada en parte porque no todas las clínicas y hospitales están equipados para administrar infusiones intravenosas. El periódico reportó en diciembre de 2020 que algunos médicos no se sentían cómodos recetando el cóctel de anticuerpos, diciendo que requiere más estudio por ser nuevo. También tuvieron dificultades para elegir qué pacientes podrían beneficiarse del fármaco. Además, algunos pacientes rechazaron la terapia por no poder dedicar las dos horas necesarias para su administración y seguimiento.
Regeneron anunció que espera entregar al menos un millón de dosis de su cóctel de anticuerpos al gobierno federal antes del 30 de junio, y añadió que el gobierno puede aceptar dosis adicionaes de hasta 1.25 millones hasta septiembre.
Los anticuerpos monoclonales son proteínas creadas en laboratorio que imitan a los anticuerpos naturales que el cuerpo produce para combatir patógenos dañinos, como el virus del PCCh.
Otras empresas también han estado desarrollando fármacos de anticuerpos, entre ellas Eli Lilly, que había recibido una EUA en febrero. La distribución del medicamento de esta empresa se ha interrumpido a finales de mayo en ocho estados, donde están aumentando los casos de ciertas variantes de COVID-19. Las pruebas sugieren que la formulación de anticuerpos de Eli Lilly es ineficaz contra dichas variantes, según anunció el Departamento de Salud y Servicios Humanos.
Otro fármaco de anticuerpos de Vir Biotechnology y GlaxoSmithKline, administrado por infusión intravenosa, recibió la autorización de la FDA a finales del mes pasado.
Siga a Mimi en Twitter: @MimiNguyenLy
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.