Investigadores californianos afirman haber descubierto un «interruptor» biológico que desencadena la autodestrucción de las células cancerosas, lo que podría abrir la puerta a tratamientos mejorados.
Científicos del Centro Oncológico Integral UC Davis de Sacramento hallaron un epítopo crucial, o segmento de una proteína mayor, en el receptor CD95 que libera una señal que conduce a la muerte celular.
«Los receptores CD95, también conocidos como Fas, se denominan receptores de la muerte», señala un comunicado de prensa de la UC Davis. «Estos receptores proteínicos residen en las membranas celulares. Cuando se activan, liberan una señal que provoca la autodestrucción de las células».
El equipo de investigación de la UC Davis publicó los resultados en la revista Cell Death & Differentiation el 14 de octubre.
El autor principal del estudio, Jogender Tushir-Singh, profesor asociado del Departamento de Microbiología Médica e Inmunología, afirmó que su descubrimiento es el primero que logra atacar el «interruptor» de la muerte.
«Hemos hallado el epítopo más crítico para la señalización citotóxica de Fas, así como para la función antitumoral de las células T CAR transeúntes», afirmó Tushir-Singh en un comunicado.
Las terapias con células T receptoras de antígenos quiméricos (CAR), que suelen costar alrededor de medio millón de dólares, consisten en modificar las células T del paciente para que ataquen los tumores injertándoles un anticuerpo específico dirigido contra el tumor.
Hasta ahora, el tratamiento con células T CAR sólo ha demostrado eficacia contra la leucemia y otros cánceres de la sangre, pero no para quienes padecen tumores sólidos como el de mama, pulmón, ovario e intestino. Sin embargo, los expertos confían en que la modulación de los receptores de muerte pueda extender los beneficios de la terapia con células T CAR a los tumores sólidos.
«Los esfuerzos anteriores por dirigirnos a este receptor han sido infructuosos. Pero ahora que hemos identificado este epítopo, podría haber una vía terapéutica para dirigirse a Fas en los tumores», dijo el Sr. Tushir-Singh.
Hasta el 1 de enero de 2022, había más de 18 millones de estadounidenses con cáncer invasivo, según la Sociedad Americana del Cáncer. En 2023, se calcula que se producirán 1.9 millones de nuevos casos de cáncer en Estados Unidos y aproximadamente 609,820 muertes relacionadas con esta enfermedad, lo que convierte al cáncer en la segunda causa de muerte después de las enfermedades cardiacas. Estas proyecciones se basan en los datos de incidencia y mortalidad por cáncer comunicados hasta 2019 y 2020, respectivamente.
Históricamente, los tumores cancerosos se han tratado con cirugía, quimioterapia y radiación, que pueden tener un éxito inicial, pero los investigadores señalan que los cánceres resistentes a la terapia suelen reaparecer.
Para alterar este patrón, los investigadores están explorando inmunoterapias como los tratamientos con células T CAR y los anticuerpos que activan los receptores de puntos de control inmunitarios. Aunque los expertos lo ven prometedor, señalan que estos enfoques sólo han demostrado su eficacia en un número muy limitado de pacientes con tumores sólidos.
Esto se debe a que los microambientes tumorales «son buenos para mantener a raya a las células T y otras células inmunitarias».
«No importa lo bien que diseñemos los anticuerpos activadores del receptor inmunitario y las células T si no pueden acercarse a las células tumorales. De ahí que necesitemos crear espacios para que las células T puedan infiltrarse», subrayó el Sr. Tushir-Singh.
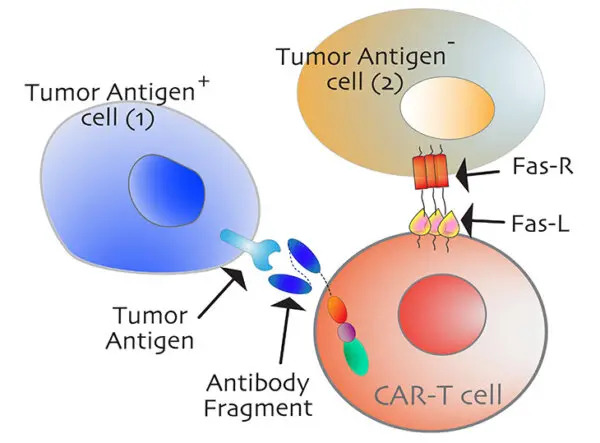
El nuevo descubrimiento del epítopo, al que el comunicado de la UC Davis se refiere como un interruptor, podría tener efectivamente un «doble golpe contra los tumores» al matar las células tumorales al mismo tiempo que hace que las inmunoterapias sean más eficaces.
Los investigadores creen que los receptores de muerte, como Fas, podrían suponer un gran avance al desencadenar la muerte celular programada en las células tumorales. El desarrollo de fármacos que potencien la actividad de los receptores de muerte podría convertirse en una herramienta crucial contra los tumores. Pero ningún agonista de Fas ha llegado a los ensayos clínicos. Sin embargo, los investigadores esperan que este nuevo descubrimiento pueda cambiar esta situación.
El estudio también sugiere que los tumores con una versión mutada del epítopo del receptor Fas podrían no responder a la terapia con células T CAR.
Este descubrimiento podría dar lugar a nuevas pruebas que identifiquen a los pacientes que más se beneficiarían de la inmunoterapia con células T CAR, y los investigadores creen que «sienta las bases» para el desarrollo de anticuerpos que activen el interruptor de destrucción de células canceladas, potencialmente para tumores sólidos.
«Se trata de un marcador definitivo de la eficacia de la terapia T CAR en el tratamiento de pacientes transeúntes», afirmó el Sr. Tushir-Singh. «Pero lo más importante es que esto sienta las bases para desarrollar anticuerpos que activen Fas, eliminen selectivamente las células tumorales y apoyen potencialmente la terapia con células T CAR en tumores sólidos».
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.