La pandemia ha terminado, pero la introducción de las vacunas contra COVID-19, que utilizan la tecnología de ARNm, significa el comienzo de una nueva era en la medicina moderna. El rezagado marco normativo que la FDA improvisó específicamente para la aprobación de las vacunas de ARNm ha sentado las bases para que se produzcan acontecimientos adversos relacionados con las terapias genéticas que utilizan esta nueva tecnología. En esta serie, revelaremos las preocupaciones emergentes sobre las inyecciones de ARNm relacionadas con las nanopartículas lipídicas, la proteína de espiga y la contaminación de la vacuna a medida que se vayan publicando documentos públicos.
Resumen de la serie de hechos clave
– Según una presentación de Moderna ante la Comisión de Bolsa y Valores en junio de 2020, «Actualmente, el ARNm es considerado un producto de terapia génica por la Administración de Alimentos y Medicamentos (FDA)».
– La FDA creó nuevas directrices, publicadas en junio de 2020, para que los productos de terapia génica se comercializaran como vacunas contra el COVID-19. No se les sometió a los mismos requisitos de ensayo que a otras terapias de ARN. Las nuevas vacunas tampoco tuvieron que someterse a estudios de biodistribución en humanos.
– Si las vacunas de ARNm se hubieran sometido a las mismas normas reglamentarias que se exigen a las nuevas terapias, probablemente se habrían identificado los tres problemas siguientes antes de autorizar su uso en humanos:
1. La cubierta de nanopartículas lipídicas (NPL) utilizada para administrar el ARNm tiene potencial inflamatorio y puede agruparse con otras NPL o deshacerse, permitiendo que el ARNm del interior se desprenda y circule libremente por el torrente sanguíneo.
2. La proteína de espiga codificada por el ARNm y su subunidad S1 se han encontrado en la sangre tras la vacunación. Tanto la proteína de espiga como la subunidad S1 están asociadas a la inflamación y la coagulación.
3. La contaminación durante el proceso de fabricación puede causar impurezas en la vacuna, como fragmentos de ARNm y plásmidos bacterianos. Las pruebas realizadas por las farmacéuticas antes de la autorización detectaron impurezas: ¿se han solucionado estos problemas?
– A pesar del prometedor potencial de las terapias con ARNm, ¿ha justificado razonablemente la emergencia pandémica la suspensión de los requisitos reglamentarios habituales?
– ¿Deberían haberse recomendado estas vacunas solo para los individuos de mayor riesgo a la espera de más pruebas en humanos? ¿Deberían las hojas informativas de las vacunas haber incluido todos los riesgos conocidos para permitir un consentimiento informado pleno y completo?
– ¿Fueron los mandatos poco éticos debido a la falta de pruebas de seguridad estándar previas a la autorización?
– Todas estas preguntas son pertinentes dado el desarrollo de nuevas vacunas de ARNm contra la gripe y el virus respiratorio sincitial (VRS). ¿Qué marco normativo se aplicará en el futuro? ¿Estarán estas nuevas vacunas de ARNm sujetas a una supervisión más estricta alineada con, tomando prestada la expresión de Moderna, la «terapia genética» o el marco rezagado utilizado para las vacunas de ARNm contra COVID-19?
Cuando se desarrolla una nueva vacuna para humanos, se somete a rigurosas pruebas de seguridad, primero en animales y luego en humanos. Para ilustrar lo que ocurrió realmente con las vacunas de ARNm, digamos que la vacuna contra COVID-19 fue el primer huevo de bioingeniería probado por la FDA para el consumo humano seguro. La «cáscara» del huevo es la cápsula de nanopartículas lipídicas (LNP) que transporta el «contenido» modificado genéticamente, el ARNm y la proteína de espiga.
La FDA decidió flexibilizar su normativa y solo probar la cáscara LNP en animales y omitir las pruebas del contenido (ARNm y la proteína de espiga) en animales o humanos. Estas pruebas habrían determinado cómo responde el organismo a la nueva tecnología (estudio de biodistribución).
En otras palabras, la FDA aprobó la primera «vacuna» de ARNm inyectada en el cuerpo humano sin comprobar la biodistribución del «contenido» (el ARNm y la proteína de espiga) para la seguridad humana. Solo comprobaron la «cáscara» de la LNP en animales antes de dar su visto bueno. Incluso los limitados datos de las pruebas de la LNP son alarmantes.
A pesar de esta falta de pruebas de seguridad adecuadas para la primera «vacuna» de ARNm utilizada en humanos, la FDA concedió la autorización y aseguró al público con certeza autorizada que todo el producto era seguro. A medida que los graves acontecimientos adversos sucedían a un ritmo sin precedentes, la FDA reafirmó sus declaraciones de seguridad, sin exigir estudios adicionales.
Los escasos datos de que disponemos son preocupantes porque demuestran que la LNP se extiende por todo el cuerpo en lugar de permanecer en un solo lugar. Este nivel limitado de pruebas no está permitido para la aprobación de otros medicamentos.
La versión europea de la FDA estadounidense, la Agencia Europea del Medicamento (EMA), se mostró más abierta que la FDA en cuanto a los limitados datos disponibles. La EMA compartió muchos detalles sobre cómo el LNP (la «cáscara») se extiende por el organismo. También expresó su preocupación por las impurezas presentes en las vacunas durante su fabricación. En esta serie trataremos a fondo estas cuestiones, incluyendo extractos de los informes de la EMA. El informe de Pfizer presentado a la FDA, que también trataremos a continuación, solo está disponible a través de una solicitud de libertad de información. ¿Por qué hay tanta reticencia a compartir los datos de las pruebas?
Normativa menos estricta para las vacunas de ARNm contra COVID
Antes de que las autoridades sanitarias aprueben un nuevo medicamento o vacuna, deben comprender cómo lo procesará el organismo.
Normalmente, se presenta a la FDA un informe de estudio farmacocinético (PK) no clínico para explicar cómo se libera, absorbe, distribuye, metaboliza y excreta el fármaco del organismo. Esto se denomina estudio de biodistribución.
Sin embargo, durante la pandemia de COVID, la FDA modificó su proceso típico de aprobación de nuevas vacunas en respuesta a la emergencia de salud pública. Las nuevas «recomendaciones no vinculantes» para la industria farmacéutica publicadas en junio de 2020 relajaron las normas para la aprobación de vacunas de ARNm en comparación con lo que se exige normalmente para la «terapia génica«.
Las nuevas directrices de la FDA permitían a las empresas presentar datos recogidos en otras plataformas de desarrollo. En otras palabras, se permitió que los estudios realizados en otros productos respaldaran la solicitud de uso de emergencia de las vacunas de ARNm.
«El desarrollo de la vacuna contra COVID-19 puede acelerarse basándose en los conocimientos adquiridos con productos similares fabricados con la misma tecnología de plataforma bien caracterizada, en la medida en que sea legal y científicamente permisible». (Página 3)
«En algunos casos, puede no ser necesario realizar estudios de seguridad no clínicos antes de los ensayos clínicos FIH [en humanos por primera vez] porque la información adecuada para caracterizar la seguridad del producto puede estar disponible a partir de otras fuentes. Por ejemplo, si la vacuna candidata contra COVID-19 se fabrica utilizando una tecnología de plataforma utilizada para fabricar una vacuna autorizada u otras vacunas en investigación previamente estudiadas y está suficientemente caracterizada, puede ser posible utilizar datos toxicológicos (por ejemplo, datos de estudios de toxicidad de dosis repetidas, estudios de biodistribución) y datos clínicos acumulados con otros productos que utilizan la misma plataforma para apoyar los ensayos clínicos FIH para esa vacuna candidata COVID-19» (Página 7).
La solicitud de estudios de biodistribución está redactada en términos muy generales, sin la suficiente especificidad para una terapéutica novedosa como las vacunas contra COVID-19 de ARNm:
«Los estudios de biodistribución en una especie animal deben considerarse si el constructo de la vacuna es de naturaleza novedosa y no existen datos de biodistribución de la tecnología de la plataforma. Estos estudios deben realizarse si existe la probabilidad de que se altere la infectividad y el tropismo tisular o si se va a utilizar una vía de administración y una formulación novedosas». (página 7).
Aunque la FDA autorizó estos productos con estas normas laxas, otros científicos han sugerido que se necesitaba más especificidad. Por ejemplo, en una revisión de Vervaeke y sus colegas se afirmaba: «El rápido auge de las terapias con ARNm ha dado lugar a un marco normativo algo rezagado». Explican además en el resumen que debería utilizarse un «enfoque de múltiples capas» para comprender lo que hacen los nuevos productos in vivo (en el cuerpo humano). Una directriz específica propuesta por los autores afirma: «Los estudios de biodistribución de las terapias de ARN deben abarcar tanto la molécula o moléculas de ARN como los componentes individuales del portador, el fármaco combinado de ARN y portador y la proteína producida».
En otras palabras, analizar la cáscara del huevo y el contenido.
Como demostraremos, la adhesión a tales directrices habría sido muy útil antes de la autorización para uso humano. Sin embargo, hasta donde sabemos, ninguna de las vacunas actuales de ARNm contra COVID-19 ha sido sometida a tales estudios de biodistribución para evaluar la molécula de ARN y su proteína de espigo codificada. Solo la cápsula portadora LNP ha sido estudiada de esta manera, y solo en animales, no en humanos.
Revisión de la FDA del estudio de biodistribución de Pfizer
Basándose en las normas modificadas de la FDA para las vacunas de ARNm, la agencia revisó el estudio de biodistribución de la cápsula portadora LNP BNT162b2 de Pfizer informe del estudio de biodistribución del portador en noviembre de 2020 para comprender cómo funcionaría la vacuna de ARNm. El informe fue marcado como «aprobado» el 9 de noviembre de 2020, en la parte izquierda del (pdf).
Como se presentará aquí y en la Parte 2, este informe fue ampliamente aprobado por la Agencia Europea del Medicamento, la Asociación Australiana de Productos Terapéuticos y el gobierno japonés.
Sin embargo, el LNP es solo el portador del ARNm de la vacuna (la «cáscara» del «huevo»); no es el ingrediente activo clave de la vacuna de ARNm (el contenido del «huevo»).
Además, el interior del huevo se sustituyó por un sustituto: el ARNm transportado en el estudio del LNP codificaba (luciferasa), no el mismo ARNm que codifica la proteína de espiga utilizado en la vacuna. Por último, dos de los lípidos utilizados en la molécula LNP no habían sido autorizados previamente para su uso en humanos. Así pues, se estaban desarrollando nuevos lípidos para transportar una vacuna novedosa para una campaña de vacunación masiva, pero no se solicitaron estudios de biodistribución en humanos.
La FDA suele exigir estudios en humanos en las primeras fases del desarrollo de fármacos, y se habrían necesitado tan solo seis voluntarios sanos. Dado que nuestro organismo fabrica la proteína de la espiga una vez inyectada la vacuna, deberían haberse realizado estudios en humanos para evaluar la producción, distribución y metabolismo del ARNm y la proteína de la espiga en todo el organismo.
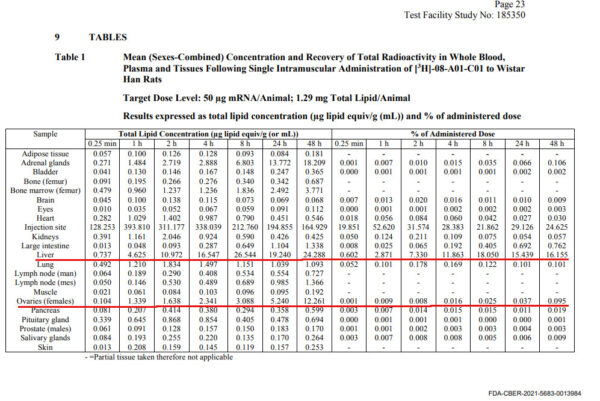
Aunque no es lo ideal, los estudios en animales revelan información útil. El informe del estudio de biodistribución presentado por Pfizer utilizó etiquetado radiactivo para marcar los LNP en la vacuna administrada a 21 ratas macho y 21 ratas hembra (página 9). Esto permitió a los científicos rastrear y cuantificar la cantidad de vacuna que llegaba a diversos órganos durante las 48 horas siguientes a la inyección.
Las ratas fueron inyectadas con 50 microgramos de vacuna de ARNm. A los 15 minutos, además de tener una concentración relativamente alta de ARNm en el lugar de la inyección, la vacuna empezó a dispersarse por distintos órganos del cuerpo, llegando primero al hígado y al bazo.
Al cabo de una hora, la concentración de la vacuna en el hígado y el bazo aumentó aún más y alcanzó las glándulas suprarrenales y la médula ósea.
Después de 24 horas, los investigadores examinaron la distribución de la vacuna de ARNm en las ratas y descubrieron que, además del nivel más alto en el lugar de la inyección, los siguientes niveles más altos se encontraban en el bazo, el hígado, las glándulas suprarrenales, los ovarios, la médula ósea, los ganglios linfáticos, los riñones, los músculos y el corazón, en orden de concentración. A continuación, busque el número 24,288 para la lectura del hígado a las 48 horas. Este número puede encontrarse tanto en el informe australiano como en el japonés, que se analizarán en la Parte 2 de esta serie.
Figura 1: Datos del estudio de biodistribución en ratas en un informe de la FDA
Los CDC eliminan en silencio un mensaje tranquilizador
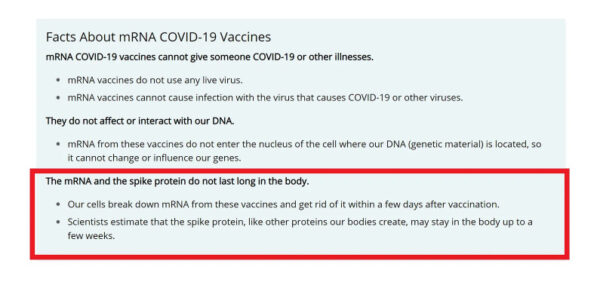
Tras emitir la autorización, los Centros para el Control y la Prevención de Enfermedades (CDC) de Estados Unidos intentaron calmar los temores sobre la toxicidad y afirmaron que el ARNm se descompone y se elimina del organismo rápidamente, mientras que la proteína de espiga puede tardar más en eliminarse. (Figura 2a)
Sin embargo, la afirmación que aparece a continuación en el recuadro rojo, que se publicó en el sitio web de los CDC el 15 de julio de 2022, se ha eliminado discretamente. Al hacerlo, ¿reconoce el CDC que faltan pruebas que respalden estas afirmaciones?
Figura 2a: Reafirmación de los CDC de que el ARNm y la proteína de espiga se desintegran rápidamente
En algún momento después de julio de 2022, los CDC actualizaron esta página web para tranquilizar al público, asegurando que las vacunas de ARNm no se integran en el genoma humano, sin mencionar cuánto tiempo durarán la proteína de espiga y el ARNm en el cuerpo. (Figura 2b)
Figura 2b: Los CDC aseguran que el ARNm no entra en el núcleo celular

¿Por qué los CDC cambiaron los mensajes en su sitio web para centrarse en la integración del ADN en lugar de cuánto tiempo duran el ARNm y la proteína de espiga en el cuerpo?
Siguiente: Un examen más detallado de los informes de las autoridades sanitarias de Australia, Japón y Europa permite comprender por qué los CDC pueden haber retirado esta afirmación de que el ARNm se descompone rápidamente y que la proteína de espiga no perdura en el organismo. Los informes de la Agencia Europea del Medicamento (EMA) muestran por dónde viajan la cubierta de LNP y el ARNm por todo el cuerpo.
Referencias
Addgene. Referencia de biología molecular.
Alana F Ogata, Chi-An Cheng, Michaël Desjardins, Yasmeen Senussi, Amy C Sherman, Megan Powell, Lewis Novack, Salena Von, Xiaofang Li, Lindsey R Baden, David R Walt, Circulación Severa del Síndrome Respiratorio Agudo Coronavirus 2 (SARS-CoV-2) Vacuna Antígeno Detectado en el Plasma de mRNA-1273 Receptores de Vacuna, Enfermedades Infecciosas Clínicas, Volumen 74, Número 4, 15 de febrero de 2022, Páginas 715-718.
Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y. Transcripción Intracelular reversa de Pfizer BioNTech COVID-19 mRNA Vacuna BNT162b2 in vitro en hígado humano línea celular. Curr Issues Mol Biol. 2022 Feb 25;44(3):1115-1126. doi: 10.3390/cimb44030073. PMID: 35723296; PMCID: PMC8946961.
Anderson EJ, Rouphael NG, Widge AT, et al. Seguridad e inmunogenicidad de la vacuna SARS-CoV-2 mRNA-1273 en adultos mayores N Engl J Med 2020; 383:2427-2438
Anderson S. CBER Planes para Monitorear la Seguridad y Efectividad de la Vacuna COVID-19. 20 de octubre de 2020. Consultado el 20/3/23.
Angeli F, Spanevello A, Reboldi G, Visca D, Verdecchia P. SARS-CoV-2 vacunas: Luces y sombras. Eur J Intern Med. 2021 Jun;88:1-8. doi: 10.1016/j.ejim.2021.04.019. Epub 2021 Abr 30. PMID: 33966930; PMCID: PMC8084611.
Baker, A. T., Boyd, R. J., Sarkar, D., Teijeira-Crespo, A., Chan, C. K., Bates, E., Waraich, K., Vant, J., Wilson, E., Truong, C. D., Lipka-Lloyd, M., Fromme, P., Vermaas, J., Williams, D., Machiesky, L., Heurich, M., Nagalo, B. M., Coughlan, L., Umlauf, S., Chiu, P. L., … Borad, M. J. (2021). ChAdOx1 interactúa con CAR y PF4 con implicaciones para el síndrome de trombosis con trombocitopenia. Science Advances. 7(49), eabl8213.
Baumeier C, Aleshcheva G, Harms D, Gross U, Hamm C, Assmus B, Westenfeld R, Kelm M, Rammos S, Wenzel P, Münzel T, Elsässer A, Gailani M, Perings C, Bourakkadi A, Flesch M, Kempf T, Bauersachs J, Escher F, Schultheiss H-P. Inflamación intramiocárdica tras la vacunación con COVID-19: Una serie de casos probados mediante biopsia endomiocárdica. Revista Internacional de Ciencias Moleculares. 2022; 23(13):6940.
Bloom, K., van den Berg, F. & Arbuthnot, P. Autoamplificación de vacunas de ARN para enfermedades infecciosas. Gene Ther 28, 117-129 (2021).
Chauhan, H., Mohapatra, S., Munt, D.J. et al. Caracterización físico-química y consideraciones de formulación para nanopartículas lipídicas sólidas. AAPS PharmSciTech 17, 640–651 (2016).
Chui CSL, Fan M, Wan EYF, et al. Eventos tromboembólicos y accidente cerebrovascular hemorrágico después de la vacunación con ARNm (BNT162b2) y covid-19 inactivado (CoronaVac): Un estudio de serie de casos autocontrolado. Lancet. 2022;(50).
Dag Berild J, Bergstad Larsen V, Myrup Thiesson E, et al. Análisis de eventos tromboembólicos y trombocitopénicos después de las vacunas AZD1222, BNT162b2 y MRNA-1273 COVID-19 en 3 países nórdicos. JAMA Netw Open. 2022;5(6):e2217375. doi:10.1001/jamanetworkopen.2022.17375.
daSilva RL. Microangiopatías trombóticas asociadas a virus. Hematología/Oncología y terapia con células madre. 2011:4(2):51-59.
De A, Ko YT. Por qué las formulaciones de LNPs ionizables por ARNm duran tan poco: causas y salida. Opinión experta de Drug Deliv. 2023 Feb;20(2):175–187. doi: 10.1080/17425247.2023.2162876. Epub 2023 Jan 1. PMID: 36588456.
Doshi P. BMJ 2021;373:n1244 Vacunas contra Covid-19: En la prisa por la aprobación regulatoria, ¿necesitamos más datos? | The BMJ
Ehaideb, S.N., Abdullah, M.L., Abuyassin, B. et al. Evidencia de una amplia brecha entre COVID-19 en humanos y modelos animales: una revisión sistemática. Crit Care 24, 594 (2020).
Informe de evaluación de la Agencia Europea de Medicamentos
Faizullin D, Valiullina Y, Salnikov V, Zuev Y. Interacción directa del fibrinógeno con micropartículas lipídicas que modula la cinética de coagulación y la estructura del coágulo. Nanomedicina. 2020 Jan;23:102098. doi: 10.1016/j.nano.2019.102098. Epub 2019 oct 23. PMID: 31655206.
FDA. Consideraciones para estudios de balance de masa radiomarcada en humanos–Guidance for Industry. Mayo de 2022.
FDA. Desarrollo y Licencia de Vacunas para Prevenir la COVID-19.
FDA-CBER-2021-5683-0013962 aprobado el: 09-Nov-2020. Un estudio de distribución tisular de una formulación de nanopartículas lipídicas marcadas con [3H]-ARNm que contiene ALC-0315 y ALC-0159 tras la administración intramuscular en ratas Wistar Han. INFORME FINAL Test Facility Study No. 185350 Sponsor Reference No. ALC-NC-0552.
Fertig TE, Chitoiu L, Marta DS, Ionescu VS, Cismasiu VB, Radu E, Angheluta G, Dobre M, Serbanescu A, Hinescu ME, Gherghiceanu M. Puede detectarse el ARNm de la vacuna en la sangre a los 15 días de la vacunación. Biomedicines. 2022 Jun 28;10(7):1538. doi: 10.3390/biomedicines10071538. PMID: 35884842; PMCID: PMC9313234.
Grobbelaar LM et al. SARS-CoV-2 espiga proteína S1 induce fibrin(ogen) resistente a la fibrinólisis: implicaciones para la formación de microcoágulos en COVID-19 Biosci Rep (2021) 41 (8): BSR20210611.
Hou, X., Zaks, T., Langer, R. et al. Nanopartículas lipídicas para la liberación de ARNm. Nat Rev Mater 6, 1078-1094 (2021).
Hablemos acerca de nanopartículas lípidas. Nat Rev Matter 6, 99 (2021).
Michieletto, D., Lusic, M., Marenduzzo, D. et al. Principios físicos de la integración retroviral en el genoma humano. Nat Commun 10, 575 (2019).
Moghimi, S. M., & Simberg, D. (2022). Preocupaciones proinflamatorias con nanopartículas lipídicas. Molecular therapy: The Journal of the American Society of Gene Therapy, 30(6), 2109–2110.
El podcast de Naturalmente Inspirado. Jessica Rose Ph.D. VAERS, los datos y la verdad
Ohlson J. La fabricación de plásmidos es el cuello de botella de la revolución de la medicina genética. Drug Discov Today. 2020 Oct 16;25(11):1891–3. doi: 10.1016/j.drudis.2020.09.040. Epub ahead of print. PMID: 33075470; PMCID: PMC7564888.
Perico L, Marina Morigi M, Galbusera M, et al. SARS-CoV-2 Proteína Espiga 1 activa las células endoteliales microvasculares y el sistema del complemento que conduce a la agregación plaquetaria. Front. Immunol. 2022.
Qin, S., Tang, X., Chen, Y. et al. Los tratamientos basados en ARNm: herramientas potentes y versátiles para combatir enfermedades. Sig Transduct Target Ther 7, 166 (2022).
Röltgen K, Nielsen SCA, Silva O. Impronta inmunitaria, amplitud del reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación humanas por SARS-CoV-2. Cell 2022;185(6). Cell 2022;185(6):1025-1040.
Schmeling, M, Manniche, V, Hansen, PR. Seguridad dependiente del lote de la vacuna COVID-19 de ARNm BNT162b2. Eur J Clin Invest. 2023; 00:e13998. doi:10.1111/eci.13998
Srinivasan M, Thangaraj SR, Arzoun H. Terapia génica ¿Puede curar la diabetes de tipo 1? Cureus. 2021 dic 19;13(12):e20516. doi: 10.7759/cureus.20516. PMID: 35004071; PMCID: PMC8723777.
Trougakos IP, Terpos E, Alexopoulos H, et al. Efectos adversos de las vacunas de ARNm COVID-19: la hipótesis de la espiga. Cell 2022;28(7): P542-554.
Vervaeke P, Borgos SE, Sanders NN, Combes F. Directrices reguladoras y herramientas preclínicas para estudiar la biodistribución de las terapias de ARN. Adv Drug Deliv Rev. 2022 May;184:114236. doi: 10.1016/j.addr.2022.114236. Epub 2022 Mar 26. PMID: 35351470; PMCID: PMC8957368.
Wong DWL, Klinkhammer BM, Djudjaj S, Villwock S, Timm MC, Buhl EM, Wucherpfennig S, Cacchi C, Braunschweig T, Knüchel-Clarke R, Jonigk D, Werlein C, Bülow RD, Dahl E, von Stillfried S, Boor P. Tropismo celular multisistémico del SARS-CoV-2 en autopsias de pacientes COVID-19. Cells. Cells. 2021 Jul 27;10(8):1900. doi: 10.3390/cells10081900. PMID: 34440669; PMCID: PMC8394956.
Yonker LM, Swank Z, Bartsch YC, et al. Detección de proteína de espiga circulante en la miocarditis posterior a la vacuna con ARNm COVID-19. Circulation. 2023:147(11).
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.