En esta serie, «Promesa o peligro: Problemas alarmantes de la vacuna de ARNm contra la COVID-19″, exploramos cómo la introducción de la tecnología de ARNm careció de un marco regulatorio adecuado, preparando el escenario para tres problemas principales: 1) Pruebas de seguridad inadecuadas de nanopartículas lipídicas, 2) Eventos adversos graves relacionados con la proteína de pico, y 3) impurezas residuales relacionadas con el ADN y los lípidos, así como especies de ARNm truncadas/modificadas.
Anteriormente: En la Parte 1, presentamos cómo la Administración de Alimentos y Medicamentos de EE.UU. (FDA) relajó las reglas para las vacunas de ARNm en comparación con las terapias de ARNm y discutimos los datos disponibles sobre la distribución de nanopartículas lipídicas (LNP) en todo el cuerpo según pruebas con animales, el hecho que no se realizaron pruebas en humanos y la falta de datos de biodistribución de ARNm o proteínas de pico. En las Partes 2 y Parte 3, exploramos cómo se construyen las LNP y cómo se comportan en el cuerpo y potencialmente afectan la salud. En la Parte 4 profundizamos en los posibles efectos inflamatorios y de coagulación de la proteína de pico y sus subunidades.
En la Parte 5, abordamos el tercer problema importante relacionado con la contaminación del ADN con plásmidos bacterianos residuales y ARNm truncado del proceso de fabricación. ¿Están las vacunas más contaminadas de lo que creen nuestras agencias reguladoras? ¿Debería esto generar preocupación sobre la migración al intestino o su expresión por parte de las células?
Las preguntas planteadas a lo largo de esta serie resaltan los problemas de seguridad inherentes asociados con un marco regulatorio laxo para la aprobación de las vacunas de ARNm contra el COVID-19. En este artículo, consideramos cómo la regulación laxa se relaciona con los problemas de contaminación del ADN y el ARN.
Resumen de hechos clave
-Han surgido preocupaciones sobre la contaminación del ADN en las vacunas anti-COVID de ARNm. La preocupación específica es la presencia de plásmidos de ADN residuales superiores a los esperados utilizados en la producción de ARNm original. Investigaciones independientes sugieren que la vacuna de ARNm de Pfizer puede tener altos niveles de contaminación del ADN, lo que podría exceder los límites regulatorios.
-Existen riesgos teóricos asociados con la expresión del ADN plasmídico y la migración al intestino, que podrían afectar la salud humana y el microbioma. Además, han surgido preocupaciones sobre el control de calidad y la supervisión de la fabricación de las vacunas de ARNm.
-La Agencia Europea de Medicamentos (EMA), la autoridad reguladora de medicamentos de Europa, señaló la presencia de ARN truncado y modificado como impurezas en las vacunas de ARNm contra el COVID-19, lo que plantea la necesidad de supervisión.
-En relación con el proceso de fabricación, un estudio danés comparó la tasa de eventos adversos con el tamaño del lote (número de dosis en un lote) y encontró una correlación.
El Comité Asesor sobre Prácticas de Inmunización se reunió la semana pasada para recomendar la vacuna anti-COVID actualizada. (pdf) Sin embargo, los fabricantes presentaron pocos datos de pruebas en humanos. Moderna fue el único fabricante que presentó datos de seguridad y respuesta de anticuerpos a partir de la experiencia con 101 personas. Pfizer presentó datos de respuesta de anticuerpos de 20 ratones y actualmente está recopilando datos de 400 individuos en pruebas clínicas. Durante la reunión no se presentaron datos sobre la supervisión de la fabricación.
Como parte de la evaluación de seguridad de la aprobación de medicamentos, el proceso CMC (química, fabricación y controles) se vuelve fundamental para identificar y eliminar impurezas. Establece estándares estrictos y especificaciones de producto para mantener la pureza de cada lote. El cumplimiento de estos estándares es esencial para obtener la aprobación de las autoridades sanitarias mundiales.
Imagina que eres un bebedor de café y decides comprar una bolsa de granos de café recién molidos de primera calidad en tu tienda favorita. Espera que cada bolsa contenga café molido puro y de alta calidad para preparar la taza de café perfecta. Sin embargo, cuando abres la bolsa, descubres que no se trata sólo de café; también hay una mezcla de arena y otras partículas extrañas. Esta impureza inesperada arruina por completo tu experiencia.
Así como usted confía en la pureza de sus granos de café para obtener una excelente taza de café, la industria farmacéutica, incluida la producción de vacunas, cuenta con regulaciones para garantizar buenas prácticas de fabricación. Los pacientes y consumidores esperan que estas directrices signifiquen que las formulaciones de medicamentos o vacunas estén libres de sustancias no deseadas, lo que garantiza su seguridad y eficacia.
El control de las impurezas en los productos químicos tradicionales es una práctica bien establecida, pero para productos biológicos como las vacunas basadas en ARNm, el manejo de las impurezas presenta desafíos únicos.
Los productos de ARNm contienen “fábricas de genes”
El ADN bicatenario o ADN de doble cadena (ADNbc) se utiliza para producir el ARNm contenido en las vacunas contra la COVID-19. Los diminutos plásmidos de ADNbc son pequeñas fábricas de genes diseñados (Figura 1). Estas fábricas producen las cadenas de ARNm contenidas en las LNP. Un plásmido aparece como un pequeño microbrazalete con diferentes segmentos que representan diferentes fragmentos de genes.
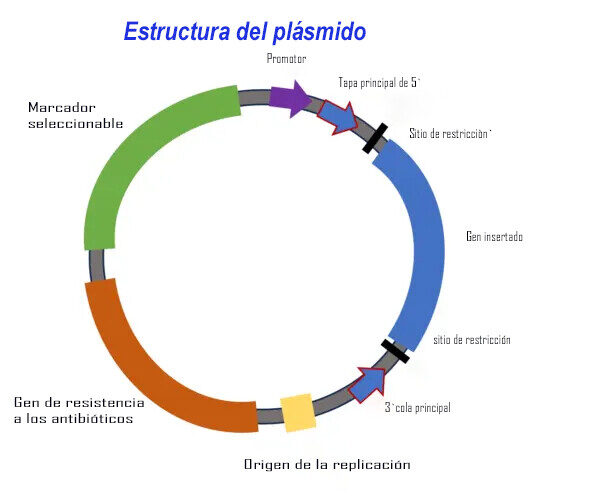
Las agencias reguladoras como la EMA (la autoridad reguladora de medicamentos de Europa) establecen límites para la cantidad de plásmidos en los lotes finales distribuidos para inyección. Han surgido nuevas preguntas sobre cuánta contaminación existe y si la FDA está monitoreándola. Tampoco está claro si los plásmidos pueden fusionarse con genes humanos dentro de la célula o viajar al intestino.
El estándar de la EMA para la contaminación de los viales por ADN es del 0.33 por ciento (330 pg/mg), o aproximadamente una molécula de ADN por cada 3000 moléculas de ARNm. Aunque la vacuna Moderna mRNA-1273 cumple con este estándar, el volumen real puede ser mayor debido a un control de calidad deficiente. El ADN debe eliminarse del producto final antes de su distribución, pero se espera que quede algo de cantidad residual. Las preguntas sin respuesta incluyen: ¿Cuánto ADN hay en los viales? ¿Está por encima del límite? ¿La FDA está siguiendo esto? ¿Y cuáles son las implicaciones, si las hay, con respecto a la perseverancia del receptor?
Hay al menos dos grupos independientes de investigadores que realizaron pruebas de laboratorio y confirmaron que la vacuna de ARNm de Pfizer ha sido contaminada por ADN.
Un equipo de científicos, dirigido por el microbiólogo Kevin McKernan, publicó un artículo preliminar que muestra que la vacuna Pfizer/BioNTech BNT162b2 tiene “órdenes de magnitud superiores al límite de la EMA” de ADN. Su artículo aún no ha sido revisado por pares. Los lotes examinados, proporcionados por una fuente anónima, eran viales vencidos y sin abrir que no se entregaron en hielo seco. Si estos datos son válidos, la cantidad real de plásmidos era entre 18 y 70 veces mayor que el límite de la EMA. (Tabla 3, página 12.)
Obviamente, futuras investigaciones deberían intentar establecer niveles de contaminación utilizando dosis no vencidas con una cadena de frío intacta.
El profesor Phillip Buckhaults, doctor en bioquímica y biología molecular y considerado un experto en investigación genómica del cáncer en la Universidad de Carolina del Sur, realizó un análisis independiente para detectar la presencia de ADN en lotes de Pfizer.
El profesor Buckhaults en su testimonio declaró lo siguiente:
«La vacuna de Pfizer está contaminada con ADN plasmídico. No es sólo ARNm. Tiene fragmentos de ADN. Este ADN es el vector de ADN que se utilizó como plantilla para la reacción de transcripción in vitro cuando fabricaron el ARNm. Sé que esto es cierto porque lo he secuenciado en mi propio laboratorio».
Continuaremos siguiendo esta línea de investigación.
Riesgo teórico de contaminación por ADN plasmídico
Si bien tener algo de ADN en una muestra es inevitable y se considera aceptable, algunos han planteado dudas sobre la posibilidad de integración genómica del ADN. Nuestras células utilizan el ADN en el núcleo para producir proteínas, por lo que, si el ADN plásmido ingresa al núcleo, existe un riesgo teórico de que pueda transcribirse y producir una proteína.
Alrededor del 5 al 10 por ciento de nuestro genoma humano contiene ADN retroviral antiguo. Sin embargo, este ADN está mutado hasta un punto que ya no es dañino. Por lo tanto, cualquier investigación adicional sobre este tema deberá establecer no sólo la presencia de integración de plásmidos de ADN, sino también su actividad biológica.
El profesor Buckhaults comentó además en su testimonio:
«Estoy un poco alarmado por las posibles consecuencias de esto, tanto en términos de salud humana como de biología, pero usted debería estar alarmado por el proceso regulador que permitió que llegara hasta ahí».
Preocupaciones sobre la migración del ADN al intestino
Relacionada con la contaminación del ADN está la preocupación por los vectores de expresión residuales, o plásmidos, en los viales. Para fabricar 1000 millones de dosis de vacuna de ARNm, se necesita más de un kilogramo de ADN. Los plásmidos ayudan a producir ADN empalmando la secuencia deseada en un plásmido bacteriano (Figura 1).
Luego, las bacterias resistentes, a menudo E. coli, ayudan a generar el ADN para su producción. Estas bacterias tienen una carga adicional: Deben replicar no sólo su propio genoma sino también el ADN plasmídico insertado dentro de su genoma. Esto lleva un poco más de tiempo, por lo que las bacterias sin ADN adicional eventualmente superarán a las que sí lo tienen.
Para resolver este problema, los científicos también insertan un gen de resistencia a los antibióticos. Luego, todo el conjunto de bacterias se trata con un antibiótico para matar las bacterias que se replican más rápido sin la resistencia a los antibióticos conferida. Esta eliminación selectiva permite que las bacterias resistentes a los antibióticos portadoras de plásmidos sigan creciendo. En otras palabras, este gen de resistencia a los antibióticos confiere una ventaja que impulsa la presión de selección para favorecer a las bacterias que producen el ADN deseado.
Sin embargo, a algunos científicos les preocupa que exceder los estándares de la EMA para la contaminación de plásmidos de ADN pueda aumentar un problema de resistencia a los antibióticos que ya está en aumento. Esto sería una preocupación potencial sólo si los plásmidos que contienen el gen de resistencia a los antibióticos migran al intestino, se integran con objetivos bacterianos en la flora intestinal y, en consecuencia, alteran el microbioma del intestino. Enfermedades como la obesidad, la diabetes, los trastornos cardiovasculares, el cáncer, la hipertensión y el síndrome del intestino irritable se han relacionado vagamente con alteraciones del microbioma intestinal.
Contaminación por ARNm truncado
La contaminación por ácido nucleico con fragmentos de ARNm truncados o acortados es algo que la EMA ha estado siguiendo desde febrero de 2021. En la página 35 del informe de evaluación de la EMA (pdf) sobre la vacuna de ARNm BNT162b2 revisada en la Parte 1, la EMA afirma: «El ARN truncado y modificado está presente como impurezas». La agencia señaló que las impurezas se encontraron en diferentes niveles durante la producción. Por ejemplo, los niveles pueden ser más altos en lotes de prueba más pequeños que en lotes comerciales más grandes.
De hecho, los científicos daneses Max Schmeling, Vibeke Manniche y Peter Riis Hansen vincularon los eventos adversos con los registros de vacunación y descubrieron que lotes más pequeños de la vacuna de ARNm BNT162b2 pueden tener una mayor tasa de eventos adversos (EA). Si bien este hallazgo es intrigante, los autores piden más investigaciones para ver si se trata de un patrón consistente. Revisamos los datos brutos proporcionados por los autores y coincidimos en que parece encontrarse una agrupación de EA en lotes que tienen menos de 100,000 dosis.
Ya se ha demostrado in vitro en un experimento de laboratorio que el ARNm puede transcribirse inversamente a ADN en seis horas. Una pregunta pendiente es si esto puede suceder en un organismo vivo. Hasta el momento, no hay evidencia de que un producto de ADN con transcripción inversa pueda fusionarse con el genoma de una célula humana. Las afirmaciones sobre la integración son únicamente especulativas y se basan en un precedente evolutivo de tal proceso.
La EMA solicitó pruebas adicionales, pero permitió que continuara la distribución. Los científicos creían que era poco probable que estos fragmentos fueran fragmentos de ARNm intactos. Un fragmento de ARNm intacto debe tener una tapa y una cola. La tapa y la cola son necesarias para indicarle a la célula cuándo comenzar y dejar de producir la proteína de pico.
Sin embargo, la EMA solicitó informes adicionales. A la agencia le preocupaba que se pudiera desencadenar una reacción autoinmune si las proteínas potencialmente codificadas de los fragmentos se parecían a las proteínas humanas. En otras palabras, si los fragmentos «imitan» a las proteínas humanas, se podrían desarrollar anticuerpos contra nuestro propio cuerpo.
«Se debe evaluar cualquier homología entre las proteínas traducidas (que no sean la proteína de pico prevista) y las proteínas humanas que, debido al mimetismo molecular, puedan causar un proceso autoinmune. Fecha límite: Julio de 2021. Informes provisionales: Marzo de 2021, y mensualmente», afirmó la EMA.
Está claro que la producción masiva de ARNm a escala industrial conlleva riesgos potenciales. Esta cuestión ha sido planteada recientemente por otros investigadores que señalan el papel del control de calidad de fabricación. Por ejemplo, The Epoch Times ha investigado anteriormente el vínculo entre los problemas de calidad y el riesgo de coagulación (Parte 1, Parte 2 y Parte 4).
Esta cuestión de la contaminación por fragmentos de ADN y ARNm también debería estudiarse más a fondo para comprender si ciertos lotes se vieron afectados más que otros. También necesitamos saber si la contaminación del ADN está relacionada con eventos adversos. La EMA debería seguir estrictamente sus estándares de seguimiento.
El problema de tener contaminación del ADN es biológicamente inevitable dado que el ARNm se transcribe a partir de vectores de ADN. El problema potencial aquí es el nivel inusualmente alto de contaminación del ADN involucrado en las vacunas de ARNm.
Sin embargo, trasladar estas terapias de ARN a una plataforma de vacunas en el contexto de un marco regulatorio rezagado nos ha dejado muchas preguntas sin respuesta. No obstante, los funcionarios de salud pública insistieron en que este nuevo producto debería implementarse de manera única, ignorando los perfiles de riesgo diferenciales de COVID-19 en una población amplia. Creemos que esto, a su vez, preparó el terreno para una extralimitación política que dio lugar a mandatos poco éticos y perjudiciales.
Lea la Parte 1: Se necesita una revisión de la FDA para nuevas vacunas y terapias de ARNm
Lea la Parte 2: Implicaciones para la salud de las pruebas deficientes de ARNm de COVID-19: Aborto espontáneo, pérdida de la visión, inmunotoxicidad
Lea la Parte 3: Corriendo el telón: El diseño de nanopartículas lipídicas de ARNm creó potencial para la coagulación y desencadenar una sobremarcha inmune
Lea la Parte 4: Una inmersión más profunda en el papel de la proteína pico en la miocarditis y la coagulación sanguínea después de la vacunación contra el COVID-19
Siguiente: En la Parte 6, discutiremos si la FDA debería haber flexibilizado las regulaciones sobre las vacunas de ARNm durante la pandemia y las consecuencias de seguridad de los retrasos regulatorios.
◊ Referencias
Alana F Ogata, Chi-An Cheng, Michaël Desjardins, Yasmeen Senussi, Amy C Sherman, Megan Powell, Lewis Novack, Salena Von, Xiaofang Li, Lindsey R Baden, David R Walt, Síndrome respiratorio agudo severo circulante por coronavirus 2 (SARS-CoV) -2) Antígeno de la vacuna detectado en el plasma de los receptores de la vacuna mRNA-1273, Enfermedades infecciosas clínicas, volumen 74, número 4, 15 de febrero de 2022, páginas 715–718, https://doi.org/10.1093/cid/ciab465
Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y. Transcripción inversa intracelular de la vacuna de ARNm BNT162b2 de Pfizer BioNTech COVID-19 in vitro en una línea celular de hígado humano. Problemas actuales Mol Biol. 25 de febrero de 2022; 44(3):1115-1126. doi: 10.3390/cimb44030073. PMID: 35723296; PMCID: PMC8946961. https://pubmed.ncbi.nlm.nih.gov/35723296/
Reacciones alérgicas, incluida anafilaxia, después de recibir la primera dosis de la vacuna Pfizer-BioNTech COVID-19, Estados Unidos, 14 al 23 de diciembre de 2020. MMWR Morb Mortal Wkly Rep 2021;70:46–51. DOI: http://dx.doi.org/10.15585/mmwr.mm7002e1
Anderson EJ, Rouphael NG, Widge AT, et al. Seguridad e inmunogenicidad de la vacuna SARS-CoV-2 mRNA-1273 en adultos mayores N Engl J Med 2020; 383:2427-2438 https://www.nejm.org/doi/full/10.1056/NEJMoa2028436
Anderson S. Planes del CBER para monitorear la seguridad y eficacia de la vacuna COVID-19. https://stacks.cdc.gov/view/cdc/97349 20 de octubre de 2020. Consultado el 20/03/23.
Angeli F, Spanevello A, Reboldi G, Visca D, Verdecchia P. Vacunas SARS-CoV-2: Luces y sombras. Eur J Intern Med. Junio de 2021; 88:1-8. doi: 10.1016/j.ejim.2021.04.019. Publicación electrónica del 30 de abril de 2021. PMID: 33966930; PMCID: PMC8084611. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8084611/#bib0043
Baker, A. T., Boyd, R. J., Sarkar, D., Teijeira-Crespo, A., Chan, C. K., Bates, E., Waraich, K., Vant, J., Wilson, E., Truong, C. D., Lipka- Lloyd, M., Fromme, P., Vermaas, J., Williams, D., Machiesky, L., Heurich, M., Nagalo, B. M., Coughlan, L., Umlauf, S., Chiu, P. L., … Borad , MJ (2021). ChAdOx1 interactúa con CAR y PF4 con implicaciones para la trombosis con síndrome de trombocitopenia. Avances científicos. 7(49), eabl8213. https://doi.org/10.1126/sciadv.abl8213
Baumeier C, Aleshcheva G, Harms D, Gross U, Hamm C, Assmus B, Westenfeld R, Kelm M, Rammos S, Wenzel P, Münzel T, Elsässer A, Gailani M, Perings C, Bourakkadi A, Flesch M, Kempf T , Bauersachs J, Escher F, Schultheiss H-P. Inflamación intramiocárdica después de la vacunación COVID-19: Una serie de casos comprobados por biopsia endomiocárdica. Revista Internacional de Ciencias Moleculares. 2022; 23(13):6940. https://doi.org/10.3390/ijms23136940
Bloom, K., van den Berg, F. y Arbuthnot, P. Vacunas de ARN autoamplificadoras para enfermedades infecciosas. Gene Ther 28, 117-129 (2021). https://doi.org/10.1038/s41434-020-00204-y.
Chauhan, H., Mohapatra, S., Munt, DJ. et al. Caracterización físico-química y consideraciones de formulación de nanopartículas lipídicas sólidas. AAPS PharmSciTech 17, 640–651 (2016). https://doi.org/10.1208/s12249-015-0394-x
Chui CSL, Fan M, Wan EYF, et al. Eventos tromboembólicos y accidente cerebrovascular hemorrágico después de la vacunación con ARNm (BNT162b2) y covid-19 inactivada (CoronaVac): un estudio de serie de casos autocontrolado. Lanceta. 2022;(50). https://www.thelancet.com/journals/eclinm/article/PIIS2589-5370(22)00234-6/fulltext
Dag Berild J, Bergstad Larsen V, Myrup Thiesson E, et al. Análisis de eventos tromboembólicos y trombocitopénicos después de las vacunas COVID-19 AZD1222, BNT162b2 y MRNA-1273 en 3 países nórdicos. Abierto de red JAMA. 2022;5(6): e2217375. doi:10.1001/jamanetworkopen.2022.17375 https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2793348
daSilva RL. Microangiopatías trombóticas asociadas a virus. Hematología/Oncología y Terapia con Células Madre. 2011:4(2):51-59. https://www.sciencedirect.com/science/article/pii/S165838761150038X
De A, Ko YT. Por qué las formulaciones de LNP ionizables con ARNm tienen una vida tan corta: Causas y solución. Opinión de expertos Entrega de medicamentos. 2023 febrero;20(2):175-187. doi: 10.1080/17425247.2023.2162876. Publicación electrónica del 1 de enero de 2023. PMID: 36588456. https://pubmed.ncbi.nlm.nih.gov/36588456/
Ehaideb, SN, Abdullah, ML, Abuyassin, B. et al. Evidencia de una amplia brecha entre COVID-19 en humanos y modelos animales: Una revisión sistemática. Cuidado crítico 24, 594 (2020). https://doi.org/10.1186/s13054-020-03304-8
Agencia Europea de Medicamentos (pdf)
Faizullin D, Valiullina Y, Salnikov V, Zuev Y. La interacción directa del fibrinógeno con micropartículas lipídicas modula la cinética de la coagulación y la estructura del coágulo. Nanomedicina. 23 de enero de 2020: 102098. doi: 10.1016/j.nano.2019.102098. Publicación electrónica del 23 de octubre de 2019. PMID: 31655206. https://pubmed.ncbi.nlm.nih.gov/31655206/
FDA. Consideraciones para estudios de equilibrio de masa radiomarcada en humanos: Orientación para la industria. https://www.fda.gov/media/158178/download mayo de 2022.
FDA. Desarrollo y Licencia de Vacunas para Prevenir el COVID-19. https://www.fda.gov/media/139638/download
DA. Desarrollo y Licencia de Vacunas para Prevenir el COVID-19. https://www.fda.gov/media/139638/download
FDA-CBER-2021-5683-0013962 aprobado el: 09-nov-2020. Un estudio de distribución tisular de una formulación de ARNm de nanopartículas lipídicas marcadas con [3H] que contiene ALC-0315 y ALC-0159 después de la administración intramuscular en ratas Wistar Han. INFORME FINAL Estudio de instalaciones de pruebas N.° 185350 N.° de referencia del patrocinador ALC-NC-0552 (pdf)
Fertig TE, Chitoiu L, Marta DS, Ionescu VS, Cismasiu VB, Radu E, Angheluta G, Dobre M, Serbanescu A, Hinescu ME, Gherghiceanu M. El ARNm de la vacuna se puede detectar en la sangre 15 días después de la vacunación. Biomedicinas. 28 de junio de 2022; 10 (7): 1538. doi: 10.3390/biomedicinas10071538. PMID: 35884842; PMCID: PMC9313234. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9313234/
Grobbelaar LM et al. La proteína de pico S1 del SARS-CoV-2 induce fibrina (ógeno) resistente a la fibrinólisis: Implicaciones para la formación de microcoágulos en COVID-19 Biosci Rep (2021) 41 (8): BSR20210611. https://doi.org/10.1042/BSR20210611
Hou, X., Zaks, T., Langer, R. et al. Nanopartículas lipídicas para la entrega de ARNm. Nat Rev Mater 6, 1078–1094 (2021). https://doi.org/10.1038/s41578-021-00358-0
Iaboni A, Jindal N, Betschel SD, Song C. Seguridad de la segunda dosis de la vacuna de ARNm COVID-19 en pacientes con reacciones inmediatas después de la primera dosis: una serie de casos. Revista de Alergia e Inmunología Clínica: Global. 2022;1(3): 172-174. https://www.sciencedirect.com/science/article/pii/S2772829322000200
Hablemos de nanopartículas lipídicas. Nat Rev Mater 6, 99 (2021). https://www.nature.com/articles/s41578-021-00281-4
Li, JX., Wang, YH., Bair, H. et al. Evaluación del riesgo de oclusión vascular retiniana después de la vacunación COVID-19. npj Vacunas 8, 64 (2023). https://doi.org/10.1038/s41541-023-00661-7
Michieletto, D., Lusic, M., Marenduzzo, D. et al. Principios físicos de la integración retroviral en el genoma humano. Nat Comuna 10, 575 (2019). https://doi.org/10.1038/s41467-019-08333-8
Moghimi, SM y Simberg, D. (2022). Preocupaciones proinflamatorias con nanopartículas lipídicas. Terapia molecular: Revista de la Sociedad Estadounidense de Terapia Génica, 30 (6), 2109–2110. https://doi.org/10.1016/j.ymthe.2022.04.011
Podcast de inspiración natural. Jessica Rose PhD – VAERS, Datos y Verdad https://www.audible.com/pd/Jessica-Rose-PhD-VAERS-Data-And-Truth-Podcast/B09YMLJGBN?clientContext=132-5166709-6339436&loginAttempt=true&noChallengeShown=true
Ohlson J. La fabricación de plásmidos es el cuello de botella de la revolución de la medicina genética. Descubrimiento de drogas hoy. 25(11):1891–3. doi: 10.1016/j.drudis.2020.09.040. Publicación electrónica antes de la impresión. PMID: 33075470; PMCID: PMC7564888. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7564888/
Perico L, Marina Morigi M, Galbusera M, et al. La proteína de pico 1 del SARS-CoV-2 activa las células endoteliales microvasculares y el sistema del complemento, lo que conduce a la agregación plaquetaria. Frente. Inmunol. 2022 https://www.frontiersin.org/articles/10.3389/fimmu.2022.827146/full
Qin, S., Tang, X., Chen, Y. et al. Terapéutica basada en ARNm: herramientas poderosas y versátiles para combatir enfermedades. Sig Transduct Target Ther 7, 166 (2022). https://doi.org/10.1038/s41392-022-01007-w
Rafati A, Pasebani Y, Jameie M, et al. Asociación de la vacunación o infección por SARS-CoV-2 con parálisis de Bell: una revisión sistemática y un metanálisis. Cirugía de cabeza y cuello de otorrinolaringol JAMA. Publicado en línea el 27 de abril de 2023. doi:10.1001/jamaoto.2023.0160 https://jamanetwork.com/journals/jamaotolaryngology/fullarticle/2804297
Rhea EM, Logsdon AF, Hansen KM, Williams LM, Reed MJ, Baumann KK, Holden SJ, Raber J, Banks WA, Erickson MA. La proteína S1 del SARS-CoV-2 cruza la barrera hematoencefálica en ratones. Nat Neurosci. Marzo de 2021;24(3):368-378. doi: 10.1038/s41593-020-00771-8. Publicación electrónica del 16 de diciembre de 2020. PMID: 33328624; PMCID: PMC8793077. https://pubmed.ncbi.nlm.nih.gov/33328624/
Röltgen K, Nielsen SCA, Silva O. Impresión inmune, amplitud de reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación humana por SARS-CoV-2. Celda 2022;185(6):1025-1040. https://www.cell.com/cell/fulltext/S0092-8674(22)00076-9
Rosenblum HG, Gee J, Liu R, et al. Seguridad de las vacunas de ARNm administradas durante los primeros 6 meses del programa de vacunación anti-COVID de EE.UU.: Un estudio observacional de informes al Sistema de notificación de eventos adversos de vacunas y v-safe. Enfermedades infecciosas de Lancet. 2022;22(6):802-812. https://doi.org/10.1016/S1473-3099(22)00054-8
Schmeling, M, Manniche, V, Hansen, PR. Seguridad dependiente del lote de la vacuna anti-COVID de ARNm BNT162b2. Eur J Clin Invest. 2023; 00:e13998. doi:10.1111/eci.13998
Srinivasan M, Thangaraj SR, Arzoun H. Terapia génica: ¿puede curar la diabetes tipo 1? Cureus. 19 de diciembre de 2021;13(12): e20516. doi: 10.7759/cureus.20516. PMID: 35004071; PMCID: PMC8723777. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8723777/
Trougakos IP, Terpos E, Alexopoulos H, et al. Efectos adversos de las vacunas de ARNm de COVID-19: la hipótesis sobre proteínas pico. Celda 2022;28(7): P542-554. https://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(22)00103-4
rvaeke P, Borgos SE, Sanders NN, Combes F. Directrices regulatorias y herramientas preclínicas para estudiar la biodistribución de terapias de ARN. Adv Drug Deliv Rev. Mayo de 2022; 184: 114236. doi: 10.1016/j.addr.2022.114236. Publicación electrónica del 26 de marzo de 2022. PMID: 35351470; PMCID: PMC8957368. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8957368/
Wong DWL, Klinkhammer BM, Djudjaj S, Villwock S, Timm MC, Buhl EM, Wucherpfennig S, Cacchi C, Braunschweig T, Knüchel-Clarke R, Jonigk D, Werlein C, Bülow RD, Dahl E, von Stillfried S, Boor P Tropismo celular multisistémico del SARS-CoV-2 en autopsias de pacientes con COVID-19. Células. 27 de julio de 2021; 10 (8): 1900. doi: 10.3390/celdas10081900. PMID: 34440669; PMCID: PMC8394956.
Yonker LM, Swank Z, Bartsch YC, et al. Proteína de pico circulante detectada en miocarditis por vacuna de ARNm posterior a COVID-19. Circulación. 2023:147(11). https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.061025
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.