En esta serie, «Promesa o peligro: Cuestiones alarmantes de la vacuna contra el COVID-19 de ARNm», exploramos cómo la introducción de la tecnología de ARNm careció de un marco regulador adecuado, preparando el escenario para acontecimientos adversos graves y otras preocupaciones relacionadas con las pruebas de seguridad inadecuadas de las nanopartículas lipídicas, la proteína espicular y las impurezas residuales relacionadas con el ADN y los lípidos, así como las especies de ARNm truncado/modificado.
Anteriormente: En la Parte 1, presentamos cómo la Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) relajó las normas para las vacunas de ARNm en comparación con las terapias de ARNm y discutimos los datos disponibles sobre la distribución de las nanopartículas lipídicas (SLN) por el cuerpo basándonos en pruebas con animales, el hecho de que no se hicieran pruebas en humanos y la falta de datos sobre la biodistribución del ARNm o la proteína espicular. En las Partes 2 y 3, exploramos cómo se construyen las SLN y cómo se comportan en el cuerpo y afectan a la salud.
Ahora pasamos a otro problema: la carga contenida en las cápsulas de las SLN: el ARNm y su proteína de espiga codificada. Presentamos la respuesta inflamatoria a la proteína espicular y a una de sus subunidades proteicas y cómo pueden contribuir a acontecimientos adversos graves como la miocarditis y la coagulación sanguínea.
Rochelle Walensky, exdirectora de los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) de EE. UU., dijo en «Good Morning America» en junio de 2021 que los casos de miocarditis son «realmente bastante raros… leves, autolimitados, generalmente se resuelven con reposo y medicación estándar». Sin embargo, esta afirmación se hizo basándose en una revisión preliminar de 300 casos y antes de realizar un seguimiento a largo plazo.
Un estudio publicado el 1 de agosto realizó un seguimiento de 40 adolescentes de Hong Kong durante un año. Las pruebas de seguimiento realizadas en 26 pacientes con hallazgos anormales iniciales revelaron que el 58% de los que tenían miocarditis asociada a la vacuna presentaban cicatrices persistentes en el músculo cardiaco. Los autores concluyeron: «Existe un efecto potencial a largo plazo sobre la capacidad de realizar ejercicios y la reserva funcional cardiaca durante el esfuerzo».
Esta serie demuestra cómo la exposición a la proteína espicular provoca problemas cardiovasculares posteriores. Dado que la vacunación hace que el organismo produzca más proteína espicular, está claro que se necesitaba más investigación para comprender las repercusiones sanitarias de la vacunación antes de autorizarla.
Resumen de hechos clave
-La proteína espicular del SRAS-CoV-2 y su subunidad S1 tienen efectos conocidos en el sistema cardiovascular, como un mayor riesgo de coagulación sanguínea.
-La proteína espicular inducida por la vacuna y su subunidad S1 se han encontrado en la sangre tras la vacunación.
-En estudios de laboratorio, la proteína espicular activa los glóbulos blancos y puede desencadenar una respuesta inflamatoria o la coagulación.
-Se encontró proteína espicular libre en la sangre de adolescentes y adultos jóvenes con miocarditis postvacunación, pero no en sujetos de control sanos sin miocarditis.
-La subunidad S1 puede interactuar con la ECA2, las plaquetas y la fibrina, y puede ser lo que provoque una respuesta inflamatoria que cause acontecimientos adversos graves, como coágulos, miocarditis y problemas neurológicos.
-Como se expone en la Parte 3, las nanopartículas lipídicas (NPL) actúan como adyuvantes, estimulando el sistema inmunitario. Esta respuesta inmunitaria innata alcanza su punto máximo a las seis horas de la vacunación y vuelve a su estado basal alrededor del noveno día, lo que se corresponde temporalmente con el inicio de la miocarditis, que suele producirse en los primeros siete días tras la vacunación contra COVID-19 con ARNm.
-No se han realizado estudios para evaluar cómo afecta la vacunación a quienes ya han sido infectados por el SARS-CoV-2.
-La proteína espicular estuvo implicada en microcoágulos de vasos pequeños durante la enfermedad por COVID-19; por tanto, deberían haberse previsto efectos cardiovasculares postvacunación.
Ya ha pasado el primer plazo para los estudios de seguridad posteriores a la autorización exigidos por la FDA, pero por lo que sabemos, el informe completo no se ha puesto a disposición del público.
La proteína espicular sobresale del virus SARS-CoV-2 como una corona de asas pegajosas. La función de la proteína espicular es agarrarse al receptor ACE2 para que el virus pueda entrar en la célula. El receptor ACE2 se encuentra en muchas células humanas de los pulmones, los riñones, el intestino, el corazón y el revestimiento de los vasos sanguíneos.
La proteína espicular se compone de dos partes: las subunidades S1 y S2. La proteína de la subunidad S1 se sitúa en la punta de la proteína espicular y es la responsable de unirse al receptor ACE2. Una vez unida al receptor, la proteína espicular cambia de forma para permitir la entrada del virus. Una vez ha accedido al interior de la célula, el virus SARS-CoV-2 utiliza el proceso de fabricación de proteínas espiculares de la célula para fabricar nuevas proteínas víricas.
Las vacunas eficaces seleccionan antígenos reconocibles que inducen una respuesta inmunitaria sólida. Se eligió la proteína espicular para la vacuna contra el COVID-19 de ARNm porque es la responsable de adherirse a las células y conseguir la entrada. Sin embargo, las investigaciones sugieren que la proteína espicular y su subunidad S1 también pueden ser responsables de complicaciones cardiovasculares tras la infección y la vacunación.
La subunidad S2 también puede interferir en la supresión tumoral, lo que podría explicar por qué el COVID-19 puede ser más grave para los pacientes de cáncer.
La investigación demuestra que la proteína espicular se encuentra en la sangre tras la infección y la vacunación contra el COVID-19. La proteína espicular modifica la coagulación de la sangre y puede estimular una respuesta inmunitaria hiperactiva. Una mejor comprensión de estos hallazgos y de las funciones específicas que desempeñan la proteína espicular y su subunidad S1 nos ayudará a determinar quiénes corren más riesgo de padecer enfermedades graves o efectos adversos de la vacuna.
Efectos cardiovasculares de la proteína espicular tras la infección
Aunque los estudios son pequeños, se ha encontrado la proteína espicular en la sangre y los coágulos de pacientes de COVID-19 gravemente enfermos. Las pruebas clínicas sugieren una huella de los efectos cardiovasculares de la proteína espicular.
En un estudio de 41 pacientes publicado en Frontiers in Immunology, se descubrió que el 30.4% de los 23 hospitalizados tenían niveles significativos de proteína espicular en la circulación. Ninguno de los 18 individuos restantes no infectados o levemente enfermos tenía proteína espicular circulante.
Un pequeño estudio de casos y controles detectó la proteína espicular en coágulos extraídos de pacientes de COVID-19 con ictus isquémico agudo e infarto de miocardio.
Otro estudio detectó la subunidad S1 en el plasma del 64% de los pacientes de COVID-19 positivos, y los niveles de S1 se asociaron significativamente con la gravedad de la enfermedad. También se detectó la proteína nucleocápside (N), un marcador de la infección por COVID-19. Los autores especularon que la presencia de S1 y N en el plasma sugiere que los fragmentos del virus entran en el torrente sanguíneo, potencialmente debido al daño tisular.
La cadena exacta de acontecimientos no se comprende del todo. Aun así, los hallazgos de laboratorio, clínicos y de biopsias ofrecen pruebas convergentes que sugieren un papel de la proteína espicular y su subunidad S1 en la coagulación sanguínea y la lesión cardiaca.
Coágulos sanguíneos asociados a la subunidad S1 de la proteína espicular
En experimentos de laboratorio como los realizados en el estudio de Frontiers in Immunology, la subunidad S1 de la proteína espicular provoca una reacción en cadena que establece las condiciones adecuadas para que se formen coágulos. En esta reacción en cadena, la S1 se une al receptor ACE2 de las células que recubren los vasos sanguíneos. La unión a la ACE2 activa entonces las células inmunitarias.
Este efecto dominó también puede estimular la unión de las plaquetas, aumentando el riesgo de coagulación. Las plaquetas son agentes coagulantes esenciales que detienen la pérdida de sangre tras una lesión agrupándose. Los autores señalaron además que, in vitro, «nuestro grupo documentó recientemente que la exposición de sueros de pacientes graves de COVID-19 a células endoteliales inducía la agregación plaquetaria».
En otras palabras, la subunidad S1 es interesante porque, in vitro (en un tubo de ensayo), parece provocar cambios en los mecanismos de coagulación. Si la subunidad S1 puede afectar a los agentes de coagulación como la fibrina, el complemento 3 y la protrombina, éste puede ser un mecanismo a través del cual el SARS-CoV-2 puede causar complicaciones cardiovasculares. La coagulación provoca cambios en el flujo sanguíneo, lo que puede dar lugar a trombosis, ictus e infarto de miocardio.
Coágulos sanguíneos atípicos
La administración de anticoagulantes para disminuir el riesgo de formación de coágulos no pareció reducir el riesgo de coagulación en los pacientes hospitalizados o ambulatorios de COVID-19. Esto puede deberse a que los coágulos formados tras la exposición a la subunidad S1 pueden no ser coágulos sanguíneos típicos. Tres hallazgos sugieren que la subunidad S1 es importante para el riesgo de coagulación.
1. Los coágulos resisten la descomposición normal
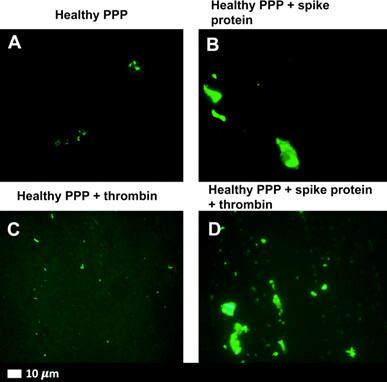
En primer lugar, cuando se añadió la subunidad S1 a sangre sana en el laboratorio, creó depósitos de coágulos densos y fibrosos. Estos coágulos fibrosos «amiloides» se formaron incluso cuando la sangre extraída de personas sanas se expuso a la subunidad S1.
La subunidad S1 parece estar asociada a una coagulación resistente a la fibrinólisis —la descomposición normal de los coágulos necesaria para restablecer el flujo sanguíneo tras una lesión. Estos coágulos amiloides se muestran en la Figura 1.
Los coágulos amiloides se producen cuando una proteína se daña y empieza a plegarse anormalmente sobre sí misma. Cuando estas proteínas amiloides anormales se acumulan en el organismo, pueden interferir en el funcionamiento normal.
Figura 1. Coágulos amiloides formados en respuesta a la S1 de la proteína espicular
2. La subunidad S1 puede inducir sustancias amiloides
En segundo lugar, estos coágulos densos pueden estar causados por determinados segmentos proteicos de la subunidad S1. La proteína espicular tiene siete segmentos proteicos (péptidos) que pueden inducir sustancias fibrosas (amiloides). Mientras que la proteína espicular totalmente intacta (subunidades S1 y S2 unidas para formar la espicular completa) no formó este amiloide, la subunidad S1 sí lo hizo. Este hallazgo es interesante porque sugiere que las subunidades de la proteína espicular pueden tener efectos únicos en las células.
3. La espicular bloquea otras proteínas inhibidoras del coágulo
En tercer lugar, la proteína espicular puede superar a otras proteínas que impiden la formación de coágulos. En otro experimento de laboratorio diseñado para comprender cómo se desarrolla este proceso, los científicos descubrieron que la proteína espicular bloquea proteínas importantes para desintegrar los coágulos.
En resumen, la investigación in vitro (en laboratorio) sugiere que la subunidad S1 de la proteína espicular puede inducir la formación de coágulos y dificultar su disolución. Aunque no sabemos con precisión cómo se traduce esto en procesos en el cuerpo, Jan Jekielek, de Epoch Times, exploró la coagulación y el papel de la proteína espicular con el patólogo Dr. Ryan Cole el 3 de junio y con el Dr. Paul Marik el 23 de mayo. En la entrevista, el Dr. Cole explicó que la proteína espicular persiste más tiempo en el organismo, inflama los tejidos dondequiera que caiga y actúa como irritante o toxina en el organismo.
La proteína espicular se encuentra en pacientes de miocarditis vacunados contra el COVID-19
Los estudios de pacientes vacunados contra COVID-19 a los que se diagnosticó miocarditis encontraron la proteína espicular en la sangre y los músculos del corazón de los pacientes, pero no en los que no tenían miocarditis.
Se encuentra en la sangre
La proteína espicular completa se ha encontrado en la sangre de adolescentes vacunados con miocarditis, pero no en la sangre de los que no tenían miocarditis.
No está claro por qué la proteína espicular circulaba libremente o no estaba unida a anticuerpos. Los adolescentes que desarrollaron miocarditis tenían marcadores inmunitarios similares a los de los que no desarrollaron miocarditis. En otras palabras, el grupo con miocarditis no parecía tener problemas inmunitarios.
Más bien, estos adolescentes podrían haber tenido una respuesta inmunitaria natural hiperactiva. Una inmunidad natural («innata») fuerte ayuda al organismo a combatir las enfermedades sin ninguna exposición previa. Sin embargo, los primeros respondedores (citocinas inflamatorias) a veces pueden ser exagerados. Si la respuesta inmunitaria innata reacciona de forma exagerada, puede desencadenar una miocarditis.
Se encuentra en el músculo cardiaco
La proteína espicular codificada por el ARNm también se ha encontrado en las células del músculo cardiaco. Se realizó un estudio de biopsia endomiocárdica (músculo cardiaco) en 15 pacientes con miocarditis tras la vacunación. No se pudo encontrar ninguna otra infección vírica que pudiera haber causado la miocarditis.
Los investigadores hallaron la proteína espicular del SARS-CoV-2 en nueve de los 15 pacientes. También se detectaron células inmunitarias (CD4+ T) en las muestras de biopsia. Estas observaciones sugieren una reacción inflamatoria a la proteína espicular.
Los autores concluyeron: «Aunque no puede establecerse una relación causal entre la vacunación y la aparición de inflamación miocárdica basándose en los hallazgos, la detección cardíaca de la proteína espicular, la inflamación dominada por las células T CD4+ y la estrecha relación temporal abogan por una reacción autoinmune desencadenada por la vacuna».
Un estudio de modelización de 2022 también sugiere que la proteína espicular puede provocar una respuesta autoinmune al imitar moléculas humanas, haciendo que los anticuerpos se unan a las proteínas «propias».
La S1 de la proteína espicular es detectada en la sangre de adultos vacunados
Otro estudio descubrió que 11 de 13 adultos vacunados con la ARNm-1273 de Moderna tenían la subunidad S1 en la sangre ya un día después de la vacunación.
Se recogió plasma de 13 participantes en distintos momentos durante el primer mes después de cada dosis. Se midieron los antígenos S1 y la espicular para estimar la cantidad de traducción del ARNm en productos proteicos.
Tras la primera dosis de 100 microgramos, se detectó el antígeno S1 en el plasma de 11 participantes. En cambio, el antígeno espicular se detectó en 3 de 13 participantes. El pico de antígeno S1 se detectó en promedio cinco días después de la vacunación. Una vez más, el momento de este pico para el S1 parece añadir indicios que sugieren una respuesta autoinmune en la semana posterior a la vacunación.
ARNm detectado en la sangre y los ganglios linfáticos tras la vacunación
El ARNm de la vacuna, que codifica la proteína espicular y su subunidad S1, también persiste en la sangre y los ganglios linfáticos. Tras la vacunación, el ARNm codificado por la espicular se ha encontrado en la sangre durante 15 días y en los ganglios linfáticos hasta 60 días. Se han encontrado exosomas cargados de espicular circulando en la sangre hasta cuatro meses. Este hallazgo es importante porque refuta la afirmación de los CDC de que el ARNm es tan frágil que se disuelve rápidamente en el lugar de la inyección (véase la Figura 2a de la Parte 1).
Los ganglios linfáticos siguen creando anticuerpos más adecuados después de cualquier infección vírica. Ésta es una forma fundamental en que nuestro organismo se prepara para nuevas variantes de forma natural. Sin embargo, unos niveles persistentemente elevados de ARNm y proteína espicular inducidos por la vacuna pueden no ser útiles cuando se pide al sistema inmunitario que responda a futuras variantes. En otras palabras, si se encarga al sistema inmunitario que siga bombeando anticuerpos contra una variante anterior, puede ser menos ágil cuando se le pida que cree un anticuerpo de alta calidad para una nueva variante.
Los ensayos clínicos inadecuados dejan preguntas sin resolver
Dado lo que sabemos sobre los efectos nocivos del virus SARS-CoV-2, no deberíamos haber supuesto que la proteína espicular codificada por la vacuna sería inocua.
Y, dado lo que sabemos sobre los problemas de coagulación tras la infección por COVID-19, los estudios futuros deberían probar si la subunidad S1 producida en respuesta a la vacunación también puede causar problemas de coagulación por la misma vía. Estos estudios deben incluir tanto experimentos de laboratorio como observaciones en humanos.
Además, desconocemos las cantidades relativas de proteína espciular libre en circulación tras la infección vs la vacunación.
En el caso de las vacunas contra el COVID-19, el principio activo no se estudió antes de su autorización. Los fabricantes utilizaron ARNm que codifica una proteína sustitutiva (luciferasa) para probar la seguridad y biodistribución de las vacunas de ARNm.
Pfizer presentó datos de biodistribución animal a las agencias reguladoras utilizando el ARN sustituto que codifica para la luciferasa, como se expone en la Parte 1 de esta serie.
Sin embargo, estos estudios eran inadecuados para describir cómo afectarían al cuerpo humano el ARNm, la proteína espicular, su subunidad S1 y el portador de nanopartículas lipídicas (SLN).
En este artículo, describimos los hallazgos de laboratorio que mostraban la coagulación asociada a la subunidad S1. Estudios como éste refuerzan por qué son tan cruciales los estudios preclínicos exhaustivos. Los estudios realizados por las empresas farmacéuticas no eran suficientes para abordar estas cuestiones.
Teníamos muy poca información sobre cómo responderían las personas a la vacunación en función de la edad, el sexo, el estado inmunitario, la salud general o los antecedentes de infección previa por el SRAS-CoV-2. Los ensayos clínicos originales no inscribieron a suficientes personas que ya se hubieran recuperado del COVID-19; no estaban diseñados para proporcionar una comprensión de cómo afectaría la infección previa a la respuesta de una persona a la vacunación.
El público no tiene acceso al estudio de seguridad posterior a la autorización exigido de Pfizer
Los estudios previos a la autorización eran claramente inadecuados. Tras la autorización, la FDA sólo ha reconocido que la vigilancia pasiva es insuficiente para establecer la seguridad. La agencia respondió a los informes de acontecimientos adversos exigiendo a Pfizer que realizara estudios adicionales, y el primer informe de vigilancia debía presentarse en octubre de 2022.
En la página 6 de la carta de aprobación, la FDA reconoce este hecho (véase la figura 2 a continuación):
«Hemos determinado que un análisis de los acontecimientos adversos espontáneos posteriores a la comercialización notificados conforme a la sección 505(k)(1) de la FDCA no será suficiente para evaluar los riesgos graves conocidos de miocarditis y pericarditis e identificar un riesgo grave inesperado de miocarditis subclínica.
Además, el sistema de farmacovigilancia que la FDA está obligada a mantener en virtud de la sección 505(k)(3) de la FDCA no es suficiente para evaluar estos riesgos graves. Por lo tanto, basándonos en los datos científicos apropiados, hemos determinado que es necesario que realice los siguientes estudios. …»
¿Ha recibido la FDA el informe de seguimiento de Pfizer, que debía presentarse antes del 31 de octubre de 2022? El próximo informe, el informe provisional, deberá presentarse en octubre.
Figura 2. Requisitos de los estudios de seguridad postcomercialización de la FDA

Lee la Parte 1 (Solo en inglés) FDA Overhaul Needed for New Vaccines and mRNA Therapies
Lee la Parte 2 (Solo en inglés) Health Implications of Poor COVID-19 mRNA Testing: Miscarriage, Vision Loss, Immunotoxicity
Lee la Parte 3 (Solo en inglés) Pulling Back the Curtain: mRNA Lipid Nanoparticle Design Created Potential for Clotting and Triggering Immune Overdrive
◊ Referencias
Addgene. Molecular Biology Reference. https://www.addgene.org/mol-bio-reference/#introduction
Alana F Ogata, Chi-An Cheng, Michaël Desjardins, Yasmeen Senussi, Amy C Sherman, Megan Powell, Lewis Novack, Salena Von, Xiaofang Li, Lindsey R Baden, David R Walt, Circulating Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Vaccine Antigen Detected in the Plasma of mRNA-1273 Vaccine Recipients, Clinical Infectious Diseases, Volume 74, Issue 4, 15 February 2022, Pages 715–718, https://doi.org/10.1093/cid/ciab465
Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y. Intracellular Reverse Transcription of Pfizer BioNTech COVID-19 mRNA Vaccine BNT162b2 In Vitro in Human Liver Cell Line. Curr Issues Mol Biol. 2022 Feb 25;44(3):1115-1126. doi: 10.3390/cimb44030073. PMID: 35723296; PMCID: PMC8946961. https://pubmed.ncbi.nlm.nih.gov/35723296/
Allergic Reactions Including Anaphylaxis After Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine — United States, December 14–23, 2020. MMWR Morb Mortal Wkly Rep 2021;70:46–51. DOI: http://dx.doi.org/10.15585/mmwr.mm7002e1
Anderson EJ, Rouphael NG, Widge AT, et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults N Engl J Med 2020; 383:2427-2438 https://www.nejm.org/doi/full/10.1056/NEJMoa2028436
Anderson S. CBER Plans for Monitoring COVID-19 Vaccine Safety and Effectiveness. https://stacks.cdc.gov/view/cdc/97349 October 20, 2020. Accessed 3/20/23.
Angeli F, Spanevello A, Reboldi G, Visca D, Verdecchia P. SARS-CoV-2 vaccines: Lights and shadows. Eur J Intern Med. 2021 Jun;88:1-8. doi: 10.1016/j.ejim.2021.04.019. Epub 2021 Apr 30. PMID: 33966930; PMCID: PMC8084611. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8084611/#bib0043
Baker, A. T., Boyd, R. J., Sarkar, D., Teijeira-Crespo, A., Chan, C. K., Bates, E., Waraich, K., Vant, J., Wilson, E., Truong, C. D., Lipka-Lloyd, M., Fromme, P., Vermaas, J., Williams, D., Machiesky, L., Heurich, M., Nagalo, B. M., Coughlan, L., Umlauf, S., Chiu, P. L., … Borad, M. J. (2021). ChAdOx1 interacts with CAR and PF4 with implications for thrombosis with thrombocytopenia syndrome. Science Advances. 7(49), eabl8213. https://doi.org/10.1126/sciadv.abl8213
Baumeier C, Aleshcheva G, Harms D, Gross U, Hamm C, Assmus B, Westenfeld R, Kelm M, Rammos S, Wenzel P, Münzel T, Elsässer A, Gailani M, Perings C, Bourakkadi A, Flesch M, Kempf T, Bauersachs J, Escher F, Schultheiss H-P. Intramyocardial Inflammation after COVID-19 Vaccination: An Endomyocardial Biopsy-Proven Case Series. International Journal of Molecular Sciences. 2022; 23(13):6940. https://doi.org/10.3390/ijms23136940
Bloom, K., van den Berg, F. & Arbuthnot, P. Self-amplifying RNA vaccines for infectious diseases. Gene Ther 28, 117–129 (2021). https://doi.org/10.1038/s41434-020-00204-y. https://www.nature.com/articles/s41434-020-00204-y
Chauhan, H., Mohapatra, S., Munt, D.J. et al. Physical-Chemical Characterization and Formulation Considerations for Solid Lipid Nanoparticles. AAPS PharmSciTech 17, 640–651 (2016). https://doi.org/10.1208/s12249-015-0394-x
Chui CSL, Fan M, Wan EYF, et al. Thromboembolic events and hemorrhagic stroke after mRNA (BNT162b2) and inactivated (CoronaVac) COVID-19 vaccination: A self-controlled case series study. Lancet. 2022;(50). https://www.thelancet.com/journals/eclinm/article/PIIS2589-5370(22)00234-6/fulltext
Dag Berild J, Bergstad Larsen V, Myrup Thiesson E, et al. Analysis of Thromboembolic and Thrombocytopenic Events After the AZD1222, BNT162b2, and MRNA-1273 COVID-19 Vaccines in 3 Nordic Countries. JAMA Netw Open. 2022;5(6):e2217375. doi:10.1001/jamanetworkopen.2022.17375 https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2793348
daSilva RL. Viral-associated thrombotic microangiopathies. Hematology/Oncology and Stem Cell Therapy. 2011:4(2):51-59. https://www.sciencedirect.com/science/article/pii/S165838761150038X
De A, Ko YT. Why mRNA-ionizable LNPs formulations are so short-lived: causes and way-out. Expert Opin Drug Deliv. 2023 Feb;20(2):175-187. doi: 10.1080/17425247.2023.2162876. Epub 2023 Jan 1. PMID: 36588456. https://pubmed.ncbi.nlm.nih.gov/36588456/
Ehaideb, S.N., Abdullah, M.L., Abuyassin, B. et al. Evidence of a wide gap between COVID-19 in humans and animal models: a systematic review. Crit Care 24, 594 (2020). https://doi.org/10.1186/s13054-020-03304-8
European Medicines Agency https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessment-report_en.pdf
Faizullin D, Valiullina Y, Salnikov V, Zuev Y. Direct interaction of fibrinogen with lipid microparticles modulates clotting kinetics and clot structure. Nanomedicine. 2020 Jan;23:102098. doi: 10.1016/j.nano.2019.102098. Epub 2019 Oct 23. PMID: 31655206. https://pubmed.ncbi.nlm.nih.gov/31655206/
FDA. Considerations for Human Radiolabeled Mass Balance Studies – Guidance for Industry. https://www.fda.gov/media/158178/download May 2022.
FDA. Development and Licensure of Vaccines to Prevent COVID-19. https://www.fda.gov/media/139638/download
FDA-CBER-2021-5683-0013962 approved on: 09-Nov-2020. A Tissue Distribution Study of a [3H]-Labeled Lipid Nanoparticle-mRNA Formulation Containing ALC-0315 and ALC-0159 Following Intramuscular Administration in Wistar Han Rats. FINAL REPORT Test Facility Study No. 185350 Sponsor Reference No. ALC-NC-0552 https://phmpt.org/wp-content/uploads/2022/03/125742_S1_M4_4223_185350.pdf
Fertig TE, Chitoiu L, Marta DS, Ionescu VS, Cismasiu VB, Radu E, Angheluta G, Dobre M, Serbanescu A, Hinescu ME, Gherghiceanu M. Vaccine mRNA Can Be Detected in Blood at 15 Days Post-Vaccination. Biomedicines. 2022 Jun 28;10(7):1538. doi: 10.3390/biomedicines10071538. PMID: 35884842; PMCID: PMC9313234. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9313234/
Grobbelaar LM et al. SARS-CoV-2 spike protein S1 induces fibrin(ogen) resistant to fibrinolysis: implications for microclot formation in COVID-19 Biosci Rep (2021) 41 (8): BSR20210611. https://doi.org/10.1042/BSR20210611
Hou, X., Zaks, T., Langer, R. et al. Lipid nanoparticles for mRNA delivery. Nat Rev Mater 6, 1078–1094 (2021). https://doi.org/10.1038/s41578-021-00358-0
Iaboni A, Jindal N, Betschel SD, Song C. Second-dose mRNA COVID-19 vaccine safety in patients with immediate reactions after the first dose: A case series. Journal of Allergy and Clinical Immunology: Global. 2022;1(3): 172-174. https://www.sciencedirect.com/science/article/pii/S2772829322000200
Let’s talk about lipid nanoparticles. Nat Rev Mater 6, 99 (2021). https://www.nature.com/articles/s41578-021-00281-4
Li, JX., Wang, YH., Bair, H. et al. Risk assessment of retinal vascular occlusion after COVID-19 vaccination. npj Vaccines 8, 64 (2023). https://doi.org/10.1038/s41541-023-00661-7
Michieletto, D., Lusic, M., Marenduzzo, D. et al. Physical principles of retroviral integration in the human genome. Nat Commun 10, 575 (2019). https://doi.org/10.1038/s41467-019-08333-8
Moghimi, S. M., & Simberg, D. (2022). Pro-inflammatory concerns with lipid nanoparticles. Molecular therapy : The Journal of the American Society of Gene Therapy, 30(6), 2109–2110. https://doi.org/10.1016/j.ymthe.2022.04.011
Naturally Inspired Podcast. Jessica Rose PhD – VAERS, Data And Truth https://www.audible.com/pd/Jessica-Rose-PhD-VAERS-Data-And-Truth-Podcast/B09YMLJGBN?clientContext=132-5166709-6339436&loginAttempt=true&noChallengeShown=true
Nunez-Castilla J, Stebliankin V, Baral P, Balbin CA, Sobhan M, Cickovski T, Mondal AM, Narasimhan G, Chapagain P, Mathee K, et al. Potential Autoimmunity Resulting from Molecular Mimicry between SARS-CoV-2 Spike and Human Proteins. Viruses. 2022; 14(7):1415. https://doi.org/10.3390/v14071415
Nyström S, Hammarström P. Amyloidogenesis of SARS-CoV-2 Spike Protein. J. Am. Chem. Soc. 2022, 144, 20, 8945–8950. https://pubs.acs.org/doi/10.1021/jacs.2c03925
Ogata AF, Maley AM, Wu C, et al. Ultra-Sensitive Serial Profiling of SARS-CoV-2 Antigens and Antibodies in Plasma to Understand Disease Progression in COVID-19 Patients with Severe Disease, Clinical Chemistry, Volume 66, Issue 12, December 2020, Pages 1562–1572, https://doi.org/10.1093/clinchem/hvaa213
Ohlson J. Plasmid manufacture is the bottleneck of the genetic medicine revolution. Drug Discov Today. 2020 Oct 16;25(11):1891–3. doi: 10.1016/j.drudis.2020.09.040. Epub ahead of print. PMID: 33075470; PMCID: PMC7564888. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7564888/
Perico L, Marina Morigi M, Galbusera M, et al. SARS-CoV-2 Spike Protein 1 Activates Microvascular Endothelial Cells and Complement System Leading to Platelet Aggregation. Front. Immunol. 2022 https://www.frontiersin.org/articles/10.3389/fimmu.2022.827146/full
Qin, S., Tang, X., Chen, Y. et al. mRNA-based therapeutics: powerful and versatile tools to combat diseases. Sig Transduct Target Ther 7, 166 (2022). https://doi.org/10.1038/s41392-022-01007-w
Rafati A, Pasebani Y, Jameie M, et al. Association of SARS-CoV-2 Vaccination or Infection With Bell Palsy: A Systematic Review and Meta-analysis. JAMA Otolaryngol Head Neck Surg. Published online April 27, 2023. doi:10.1001/jamaoto.2023.016 https://jamanetwork.com/journals/jamaotolaryngology/fullarticle/2804297
Rhea EM, Logsdon AF, Hansen KM, Williams LM, Reed MJ, Baumann KK, Holden SJ, Raber J, Banks WA, Erickson MA. The S1 protein of SARS-CoV-2 crosses the blood-brain barrier in mice. Nat Neurosci. 2021 Mar;24(3):368-378. doi: 10.1038/s41593-020-00771-8. Epub 2020 Dec 16. PMID: 33328624; PMCID: PMC8793077. https://pubmed.ncbi.nlm.nih.gov/33328624/
Röltgen K, Nielsen SCA, Silva O. Immune imprinting, breadth of variant recognition, and germinal center response in human SARS-CoV-2 infection and vaccination. Cell 2022;185(6):1025-1040. https://www.cell.com/cell/fulltext/S0092-8674(22)00076-9
Rosenblum HG, Gee J, Liu R, et al. Safety of mRNA vaccines administered during the initial 6 months of the US COVID-19 vaccination program: an observational study of reports to the Vaccine Adverse Event Reporting System and v-safe. Lancet Infectious Diseases. 2022;22(6):802-812. https://doi.org/10.1016/S1473-3099(22)00054-8
Schmeling, M, Manniche, V, Hansen, PR. Batch-dependent safety of the BNT162b2 mRNA COVID-19 vaccine. Eur J Clin Invest. 2023; 00:e13998. doi:10.1111/eci.13998. https://pubmed.ncbi.nlm.nih.gov/36997290/
Singh N, Bharara Singh A. S2 subunit of SARS-nCoV-2 interacts with tumor suppressor protein p53 and BRCA: an in silico study. Transl Oncol. 2020 Oct;13(10):100814. doi: 10.1016/j.tranon.2020.100814. Epub 2020 Jun 30. PMID: 32619819; PMCID: PMC7324311.
Srinivasan M, Thangaraj SR, Arzoun H. Gene Therapy – Can it Cure Type 1 Diabetes? Cureus. 2021 Dec 19;13(12):e20516. doi: 10.7759/cureus.20516. PMID: 35004071; PMCID: PMC8723777. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8723777/
Trougakos IP, Terpos E, Alexopoulos H, et al. Adverse effects of COVID-19 mRNA vaccines: the spike hypothesis. Cell 2022;28(7): P542-554. https://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(22)00103-4
Vervaeke P, Borgos SE, Sanders NN, Combes F. Regulatory guidelines and preclinical tools to study the biodistribution of RNA therapeutics. Adv Drug Deliv Rev. 2022 May;184:114236. doi: 10.1016/j.addr.2022.114236. Epub 2022 Mar 26. PMID: 35351470; PMCID: PMC8957368. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8957368/
Wong DWL, Klinkhammer BM, Djudjaj S, Villwock S, Timm MC, Buhl EM, Wucherpfennig S, Cacchi C, Braunschweig T, Knüchel-Clarke R, Jonigk D, Werlein C, Bülow RD, Dahl E, von Stillfried S, Boor P. Multisystemic Cellular Tropism of SARS-CoV-2 in Autopsies of COVID-19 Patients. Cells. 2021 Jul 27;10(8):1900. doi: 10.3390/cells10081900. PMID: 34440669; PMCID: PMC8394956. https://pubmed.ncbi.nlm.nih.gov/34440669/
Yonker LM, Swank Z, Bartsch YC, et al. Circulating Spike Protein Detected in Post–COVID–19 mRNA Vaccine Myocarditis. Circulation. 2023:147(11). https://www.ahajournals.org/doi/10.1161/CIRCULATIONAHA.122.061025
Yu CK, Tsao S, Ng CW, Chua GT, Chan KL, Shi J, Chan YY, Ip P, Kwan MY, Cheung YF. Cardiovascular Assessment up to One Year After COVID-19 Vaccine-Associated Myocarditis. Circulation. 2023 Aug;148(5):436-439. doi: 10.1161/CIRCULATIONAHA.123.064772. Epub 2023 Jul 31. PMID: 37523760; PMCID: PMC10373639.
Zheng Y, Zhao J, Li J, Guo Z, Sheng J, Ye X, Jin G, Wang C, Chai W, Yan J, Liu D, Liang X. SARS-CoV-2 spike protein causes blood coagulation and thrombosis by competitive binding to heparan sulfate. Int J Biol Macromol. 2021 Dec 15;193(Pt B):1124-1129. doi: 10.1016/j.ijbiomac.2021.10.112. Epub 2021 Oct 29. PMID: 34743814; PMCID: PMC8553634. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8553634/
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.