La Administración de Alimentos y Medicamentos (FDA) aprobó un número sin precedentes de autorizaciones de uso de emergencia (AUE) para medicamentos, pruebas y dispositivos médicos desde el comienzo de la pandemia.
Entre marzo del 2020 y junio del 2021, se autorizaron más de 600 AUE, según Fortune.
Esto causó preocupación entre los profesionales sanitarios, y algunos estudios afirman que la reacción exagerada de los reguladores puede haber provocado un descenso de los estándares del sector (1, 2).
Según se aclara en la revista Yale Medicine, «solo puede concederse una AUE cuando no existen alternativas adecuadas, aprobadas y disponibles, y cuando los beneficios conocidos y potenciales superan a los riesgos potenciales. Por otro lado, una AUE solo dura lo que dura la emergencia de salud pública para la que fue declarada».
Antes del 2020, la emergencia de salud pública que permitió el mayor número de AEU fue la pandemia de gripe H1N1 del 2009, con 22 AEU en total para equipos de protección individual (EPI), antivirales y pruebas diagnósticas. La única vacuna autorizada para emergencias antes de la pandemia del 2020 fue la vacuna contra el ántrax.
Dado el drástico aumento de AUEs, los expertos temen que esta vez la FDA haya ido demasiado lejos.
La normalización de los fármacos AUE y la falta de consentimiento informado
El cardiólogo Dr. Jack Askins señaló que la avalancha sin precedentes de autorizaciones de emergencia en medicamentos, vacunas, dispositivos médicos, pruebas COVID y EPI normalizó los medicamentos y productos AUE como totalmente aprobados por la FDA en lugar de ser de investigación.
La profesora Linda Wastila, de la Facultad de Farmacia de la Universidad de Maryland, experta en farmacoterapia y política farmacéutica, declaró a The Epoch Times que el torrente de 600 AUE hace muy difícil que los profesionales sanitarios se mantengan informados del estado de aprobación de los nuevos medicamentos.
Por ejemplo, Askins declaró anteriormente a The Epoch Times que se había dado cuenta de que algunos de sus colegas que recetan Paxlovid no conocían bien las numerosas interacciones y contraindicaciones del Paxlovid con otros medicamentos.
El Paxlovid puede interactuar con 43 clases de fármacos diferentes y más de 550 principios activos.
Incluso antes de la pandemia, a los médicos y farmacéuticos les resultaba difícil mantenerse al día, dado que la FDA aprueba anualmente unas 40 nuevas terapias, sin contar los medicamentos genéricos.
Wastila dijo que, en comparación con los productos tradicionales aprobados por la FDA, hubo menos consentimiento informado con los productos AUE durante la pandemia.
El consentimiento informado se define como «el proceso en el que un proveedor de atención sanitaria educa a un paciente sobre los riesgos, beneficios y alternativas de un determinado procedimiento o intervención», y los pacientes deben tomar su propia decisión voluntaria.
El consentimiento informado es especialmente importante en el caso de los AUE, ya que se trata de productos en fase de investigación. En algunos artículos sobre los AUE se comparó la toma de estos productos con la participación en ensayos experimentales (1, 2).
Parte del consentimiento informado consiste en hacer saber a los pacientes que lo que están tomando es experimental y que tienen derecho a negarse.
Pero Askins destacó que muy pocos pacientes recibieron el consentimiento informado cuando tomaron productos AUE como la vacuna.
Dijo que tres pacientes, cada uno de los cuales recibió el refuerzo bivalente como cuarta inyección, ingresaron en su clínica. Preguntó a los tres si habían recibido información sobre los riesgos potenciales y los datos que iban apareciendo sobre las preocupaciones y problemas que planteaba.
«Los tres dijeron que no», dijo, «no creo que entiendan la autorización de uso de emergencia frente a la aprobación completa de la FDA».
También hay que tener en cuenta que las autorizaciones de uso de emergencia no van acompañadas de datos de seguridad a largo plazo.
Mientras que los medicamentos plenamente aprobados por la FDA vienen con un prospecto densamente redactado sobre los efectos secundarios y los mecanismos del fármaco, en el caso de muchos productos AUE, como las vacunas COVID-19, estas secciones se dejan en blanco.
Un portavoz de Johnson & Johnson dijo que esto era intencionado, dejando a los consumidores la tarea de buscar en Internet la información más actualizada sobre seguridad y eficacia a medida que se publican los datos.
Sin embargo, Wastila considera que esta falta de información es potencialmente peligrosa.
«Al menos para mí, esto transmite el hecho de que no saben realmente si un producto es seguro y eficaz cuando se trata de un producto AUE».
La erosión de las normas de seguridad de los medicamentos
El Dr. David Bell, antiguo funcionario médico de la Organización Mundial de la Salud, afirmó que el uso excesivo de AUE durante la pandemia rebajó las normas de seguridad de los medicamentos establecidas para proteger a los pacientes.
Los productos AUE son muy diferentes de los medicamentos aprobados por la FDA. Sin embargo, el fomento del uso de AUE por parte de las agencias de salud pública difuminó la separación entre AUE y medicamentos aprobados por la FDA.
Wastila teme que los AUE estén sustituyendo a la aprobación de la FDA como norma.
«Los AUE perdieron todo su significado», afirma el Dr. Richard Amerling, internista y nefrólogo. «La gente no oye ‘uso de emergencia’; sólo oye ‘autorizado'».
Askins argumentó que han habido mensajes públicos intencionales de la FDA para hacer que AUE parezca tan seguro y equivalente a un producto completamente probado y autorizado.
En agosto del 2021, la FDA aprobó la vacuna COVID-19 de Pfizer bajo la etiqueta de Comirnaty.
Tener una vacuna aprobada por la FDA debería haber anulado la AUE para otras vacunas COVID-19, o al menos, la vacuna AUE de Pfizer.
Sin embargo, la vacuna AUE de Pfizer sigue en el mercado estadounidense. La FDA también escribió que para la vacuna de Pfizer, «las dosis distribuidas bajo la AUE son intercambiables con las dosis autorizadas».
Una orden emitida en noviembre del 2021 por el juez Allen Windsor del Tribunal de Distrito de EE.UU. para el Distrito Norte de Florida rechazó esta afirmación, declarando que, si bien las dos versiones pueden ser intercambiables desde el punto de vista médico, no son intercambiables desde el punto de vista legal.
La orden del juez Windsor también mencionaba que los funcionarios de la FDA no podían demostrar que las vacunas Comirnaty existieran siquiera en Estados Unidos.
No obstante, la plena aprobación de Comirnaty por parte de la FDA llevó a muchos proveedores sanitarios a suponer que las inyecciones de Pfizer que se administran son las versiones autorizadas.
Wastila relató una experiencia en su antigua farmacia local.
Estaba comprando unos antibióticos y, mientras charlaba con el farmacéutico, le preguntó por la aceptación de las vacunas de Pfizer y Moderna.
«El farmacéutico le dijo: ‘Oh, son geniales. Todo el mundo está muy contento de que estén aprobadas por la FDA», cuenta Wastila. «Eso es literalmente una cita de boca del farmacéutico».
«Le dije: ‘Pero no están aprobados por la FDA’. Y ella respondió: ‘Ah, Pfizer sí'».
Así que Wastila pidió ver un envase sin abrir de la vacuna, y el farmacéutico le mostró al médico un vial.
El farmacéutico presentó una vacuna AUE; no tenía la etiqueta Comirnaty, que estaría impresa según los requisitos de etiquetado.
Wastila dijo al farmacéutico que la farmacia seguía utilizando las vacunas AUE.
«El farmacéutico estaba como asombrado», dijo Wastila, «Pero no hay consentimiento informado si ni siquiera tus dispensadores son conscientes de que es AUE o aprobado por la FDA».
Es probable que se produzcan más declaraciones de emergencia y AUE
Los expertos en salud sostienen que la gestión de la pandemia COVID-19 ya rebajó los estándares para futuras declaraciones de emergencia y AUEs.
El Dr. Robert Malone, bioquímico y uno de los inventores de la plataforma de fármacos de ARNm, dijo que la viruela del mono, que fue declarada emergencia de salud pública en agosto del 2022 sin que se produjera ninguna muerte en los EE.UU. en ese momento, es un buen ejemplo de esta norma reducida.
Dado que la enfermedad afecta casi exclusivamente a hombres que tienen relaciones sexuales con hombres, un grupo demográfico específico, y provocó 20 muertes en Estados Unidos hasta el momento, tanto Bell como Wastila dijeron que era ridículo que se considerara una emergencia de salud pública.
«Ahora que el gato está fuera de la bolsa, las declaraciones de emergencia de salud pública se pueden utilizar con mucha facilidad porque hay precedentes como COVID-19 y la viruela del mono que no fueron muy graves», dijo Bell.
La vacuna contra la viruela, etiquetada comercialmente como JYNNEOS, también recibió rápidamente la aprobación de la EUA en cuestión de días.
La FDA escribió que se «infería» que una vacuna contra la viruela sería eficaz contra la viruela del mono, dado que ambos virus son de la misma familia.
Sin embargo, según una declaración realizada por los CDC el 19 de octubre del 2022, no había datos sobre la eficacia de JYNNEOS o ACAM2000, una alternativa a JYNNEOS, para la viruela del mono.

La vacuna también tiene efectos secundarios cardiológicos. Los datos agrupados de 22 estudios mostraron que de las más de 7800 personas vacunadas, seis desarrollaron acontecimientos adversos relacionados con el corazón que se determinó que estaban causalmente relacionados con la vacunación.
Aumentó la preocupación por el virus respiratorio sincitial, conocido como VRS, en los niños. Aunque el virus no fue declarado emergencia de salud pública nacional, se hicieron declaraciones en Oregón y Colorado, y algunos expertos sanitarios insisten en una declaración nacional.
«Tuvimos VSR y gripe todos los años y, de repente, se convierte en un gran problema, y es porque tenemos miedo de cada infección vírica, estamos normalizando el tener miedo de cada contagio», dijo Wastila.
Pérdida de confianza en la sanidad pública
Como profesora de farmacoterapia que está en contacto con farmacéuticos y personal que trabaja con la FDA, Wastila confesó que la pandemia fue para ella un «duro despertar».
«Médicos, dispensadores y farmacéuticos siguen ciegamente la seguridad y eficacia de un producto solo porque tiene el sello de aprobación de la FDA, aunque esa ‘aprobación’ sea una AUE».
Aunque desde hace décadas se sospecha y se habla de tratos financieros por la puerta de atrás, Malone sostiene que la pandemia hizo aflorar la «corrupción».
Desde el punto de vista financiero, el 65 por ciento del presupuesto de la FDA procede de las empresas farmacéuticas, y gran parte de este dinero llega a través del patrocinio de las solicitudes de aprobación de medicamentos.
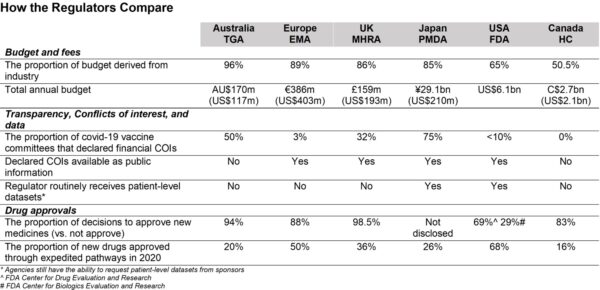
La Prescription Drug User Fee Act de 1992, también conocida como PDUFA, obliga a las empresas farmacéuticas a pagar a la FDA por la aprobación de medicamentos.
Wastila afirma que, tras hablar con colegas y estudiantes que trabajan en la FDA, tiene la sensación de que la PDFUA puede haber establecido «una cultura de derecho» por parte de las compañías farmacéuticas a que sus medicamentos sean aprobados y comercializados.
«Los patrocinadores sienten que, oye, hemos pagado por esto», dijo, «es como una situación de pagar por jugar».
Muchos miembros de las juntas de evaluación de medicamentos también reciben pagos económicos de las compañías farmacéuticas.
Cuando se evalúa un fármaco, tiene que haber «cero conflicto de intereses», dijo Amerling. «Declarar que se tiene un conflicto de intereses financieros no hace que desaparezca».
Bell dijo que la baja aceptación de las vacunas en niños menores de cinco años es una señal de que la gente ya no confía en las agencias de salud pública.
«La FDA no fue capaz de aportar datos sólidos que demuestren que las vacunas benefician a todos los niños», afirmó Bell.
Los profesionales sanitarios y los ciudadanos que antes confiaban en la FDA tienen la sensación de que ya no pueden pedir consejo sobre los tratamientos.
Amerling dijo que esto obligaría a los médicos a ser muy conservadores con sus tratamientos.
Como directora académica de The Wellness Company, Amerling educa a los médicos para que prescriban solo medicamentos con un historial de seguridad de al menos varios años.
«No sea esa persona que se sube al carro con un producto nuevo», dice. «La experiencia posterior a la comercialización puede revelar efectos adversos imprevistos, y no los va a ver ni siquiera con los estudios iniciales, aunque estén bien hechos».
«Cuando se desconoce el riesgo a medio y largo plazo, es mejor pecar de precavido, sobre todo si los beneficios son pequeños».
Wastila añadió que hubo un considerable vacío de información sobre la seguridad de los medicamentos desde la pandemia, con escaso escrutinio por parte de los reguladores farmacéuticos.
Los refuerzos bivalentes de Pfizer, por ejemplo, se aprobaron tras ser probados en ocho ratones.
Aunque la FDA solicitó estudios posteriores a la comercialización sobre miocarditis y pericarditis como parte de la aprobación de la vacuna de Pfizer (pdf), Pfizer anunció ensayos para analizar estos eventos en septiembre del 2022, casi dos años después de que las vacunas entraran en el mercado. Moderna inició dos ensayos en noviembre del 2022.
Wastila dijo que hay una gran necesidad de un regulador independiente de medicamentos que no esté afiliado financiera o profesionalmente con el gobierno, las instituciones académicas y, lo que es más importante, la industria farmacéutica para proporcionar opiniones imparciales sobre la seguridad de los medicamentos.
«La seguridad siempre fue la hijastra del mantra ‘seguro y eficaz'», señaló.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.