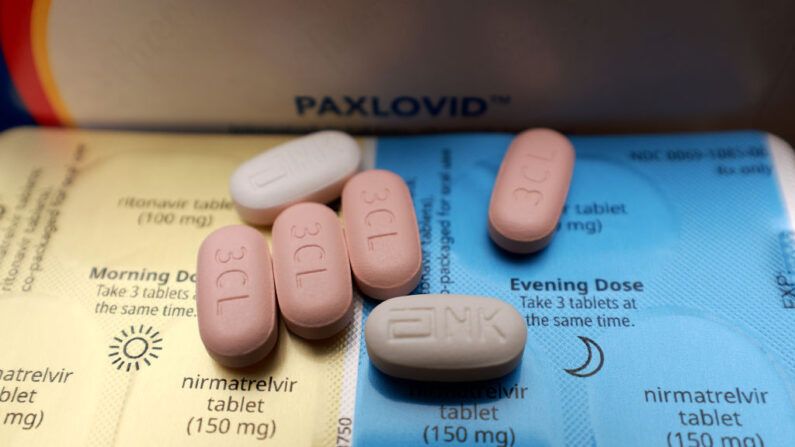
La administración de Biden y las agencias gubernamentales continúan impulsando el producto de Pfizer COVID-19 con autorización de uso de emergencia, Paxlovid, incluso con insuficientes datos de nuevos ensayos que demuestren su eficacia en la población actual.
El ensayo clínico inicial de Pfizer para Paxlovid en 2021, que le valió una autorización de uso de emergencia (EUA) por parte de la FDA, parecía bastante prometedor. Los resultados mostraron una reducción del riesgo relativo de progresión a COVID-19 grave del 89 por ciento. Pero después de que el producto no aprobado de Pfizer llegara al mercado con su EAU a cuestas, los estudios del mundo real resultaron bastante diferentes.
Dos estudios realizados entre enero y marzo de 2022, con datos basados en poblaciones reales, mostraron resultados muy diferentes. En el primer estudio, publicado en Enfermedades Infecciosas Clínicas en junio de 2022, la reducción del riesgo fue mucho menor que en el ensayo inicial de 2021 (89 por ciento), situándose en el 46 por ciento. Los resultados del segundo estudio, publicado en The New England Journal of Medicine en septiembre, no mostraron pruebas de que se evitara el COVID-19 grave en adultos menores de 65 años.
La EUA y el impulso para el uso de Paxlovid continúan a pesar de la caída de las tasas de eficacia, y la FDA aún no ha ordenado a Pfizer que produzca un nuevo ensayo clínico aleatorizado de control doble ciego para confirmar su eficacia en la población actual del mundo real.
En su lugar, la Administración de Alimentos y Medicamentos (FDA) ordenó a Pfizer que pruebe los efectos de un ciclo adicional de su antiviral Paxlovid entre las personas que experimentan un rebote de COVID-19 después del tratamiento. Cuando saltó a los titulares que tres altos funcionarios del gobierno, el presidente Joe Biden, el asesor de COVID-19 de la Casa Blanca, el Dr. Anthony Fauci, y más recientemente la directora de los Centros para el Control y la Prevención de Enfermedades (CDC), Rochelle Walensky, informaron del rebote de COVID después de tomar Paxlovid de Pfizer, marcando un giro negativo de los acontecimientos para el medicamento de Pfizer.
Pero con los tratamientos de Paxlovid a 530 dólares y el anuncio del gobierno de EE.UU. el 13 de diciembre de una nueva compra de 3,700,000 tratamientos por unos 2000 millones de dólares, además de su compra anterior de 20 millones de tratamientos de Paxlovid por 5000 millones de dólares a principios de este año, el medicamento sigue siendo bastante rentable para Pfizer.
¿Cuáles son los datos sobre Paxlovid que debemos conocer?
¿Qué es Paxlovid?
Paxlovid consta de dos fármacos activos, nirmatrelvir y ritonavir. El nirmatrelvir está diseñado para inhibir la replicación vírica y el ritonavir es un inhibidor de la proteasa que se utilizaba para el tratamiento del VIH/SIDA.
Actualmente, Paxlovid no está aprobado por la FDA para ningún uso, incluido el tratamiento de COVID-19, y sigue en fase de estudio. A finales de diciembre de 2021, la FDA concedió al medicamento en investigación la autorización de uso de emergencia (EUA) en los EE.UU. como terapia para tratar COVID-19 de leve a moderada en adultos y niños mayores de 12 años que pesen al menos 88 libras.
En la actualidad, no se ha establecido la seguridad y eficacia de Paxlovid en pacientes pediátricos menores de 18 años y no se dispone de datos, ya que los ensayos clínicos realizados hasta la fecha incluían adultos mayores de 18 años. Pfizer sí menciona que se espera que la dosis autorizada para adultos dé lugar a un resultado comparable en pacientes de 12 años o más que pesen al menos 88 libras al observado en adultos con un peso corporal similar en los ensayos.
Índices de eficacia
Los datos que apoyan la EUA se basaron en el primer ensayo clínico de Paxlovid entre el 16 de julio y el 9 de diciembre de 2021, que mostró una reducción del 89 por ciento en los resultados graves de COVID-19. Este ensayo clínico inicial se realizó en un grupo muy selecto. Los participantes eran sintomáticos y COVID-positivos, tenían al menos una afección médica subyacente con un mayor riesgo de desarrollar una enfermedad grave por COVID-19, y no tenían ninguna infección previa confirmada por SARS-CoV-2.
El primer estudio de Israel, realizado entre enero y febrero con datos poblacionales reales, se basó en un grupo más diverso. El 78 por ciento de los participantes tenían inmunidad previa a COVID-19 por una infección previa por SARS-CoV-2, o estaban vacunados, y se estimó que presentaban un alto riesgo de progresión a COVID-19 grave. El resultado mostró una reducción global del riesgo del 46 por ciento. En el estudio se señala que, dado que no se recomienda el uso de Paxlovid con varias afecciones médicas y que tiene interacciones medicamentosas complejas, puede limitarse el uso del fármaco en pacientes de alto riesgo.
El segundo estudio, que utilizó datos reales basados en la población y realizado entre enero y marzo de 2022, analizó los resultados en función de dos grupos de edad, de 40 a 64 años y de 65 años o más. Los resultados mostraron que las tasas de resultados COVID-19 graves fueron significativamente menores en adultos de 65 años o más que recibieron Paxlovid, pero no se encontraron pruebas de beneficio en adultos menores de 65 años.
En la actualidad, la FDA, los CDC y Pfizer mantienen amplias directrices de tratamiento para el Paxlovid, indicando que es para adultos y niños mayores de 12 años, con un peso mínimo de 88 libras.
El ensayo clínico más reciente de Pfizer, comunicado a finales de abril, determinó el uso profiláctico postexposición. Los participantes elegibles eran de nuevo un grupo muy específico: asintomáticos, con un resultado negativo en la prueba de detección del antígeno del SRAS-CoV-2, expuestos a un individuo sintomático positivo, no infectados por el SRAS-CoV-2 en los últimos 6 meses y que no hubieran recibido ninguna vacuna contra el SRAS-CoV-2 en los últimos 6 meses. Los resultados no fueron estadísticamente significativos y no se cumplió el criterio de valoración. Pfizer informó de reducciones del riesgo observadas del 32 por ciento (ciclo de 5 días) y del 37 por ciento (ciclo de 10 días).
Entonces, ¿por qué en cuestión de meses el nuevo medicamento «milagroso» de Pfizer parece haber perdido su poder de resistencia? ¿Qué hay de las nuevas variantes?
«Se espera que Paxlovid sea activo contra la variante ómicron y sus subvariantes, aunque actualmente se carece de datos sobre la eficacia clínica de Paxlovid contra estas variantes», afirman los Institutos Nacionales de Salud (NIH), mientras que Pfizer también afirma que el fármaco funciona contra ómicron y respalda su afirmación con tres estudios de laboratorio.
Dejando a un lado las variantes en evolución, actualmente no hay datos que permitan saber si Paxlovid es eficaz en la población actual y hasta qué punto está funcionando con una exposición e inmunidad en constante evolución. Todos los ensayos clínicos realizados hasta la fecha han tenido criterios muy selectos. Disponer de más claridad en torno a la actual oscuridad de este fármaco más pronto que tarde sería útil para todos, ya que desde mediados de abril las prescripciones de Paxlovid se han disparado a más de 160,000 por semana, según los CDC.
Efectos secundarios y contraindicaciones
Como todos los fármacos, el Paxlovid tiene potenciales efectos secundarios. Se han notificado reacciones alérgicas, reacciones de hipersensibilidad y anafilaxia, junto con problemas hepáticos y una lista de otros. También se han notificado casos de disgeusia, un trastorno del gusto que provoca un sabor agrio, amargo o metálico. Más recientemente se han notificado casos de necrólisis epidérmica tóxica y síndrome de Stevens-Johnson con ritonavir, un componente de Paxlovid. Pfizer advierte que aún se está estudiando el Paxlovid, que no muchas personas lo han tomado y que es posible que en este momento no se conozcan todos los riesgos.
Actualmente no hay datos en humanos sobre el uso de Paxlovid durante el embarazo y no se recomienda quedarse embarazada durante el tratamiento. Se informa de que también puede afectar al funcionamiento de las píldoras anticonceptivas.
En la actualidad, la FDA enumera 35 fármacos y productos a base de plantas contraindicados, incluidos medicamentos contra el cáncer y la Hierba de St. John que pueden causar efectos secundarios graves o potencialmente mortales cuando se toman con Paxlovid, así como 94 fármacos adicionales que deben evitarse.
Los NIH recomiendan que, antes de recetar Paxlovid, los profesionales sanitarios asesoren a los pacientes sobre todas las opciones de tratamiento disponibles para COVID-19 y revisen detenidamente la medicación del paciente, incluidos los medicamentos de venta libre, los suplementos a base de hierbas y las drogas recreativas, para evaluar las posibles interacciones medicamentosas.
Rebote de Paxlovid
En primavera, los médicos empezaron a informar de casos de rebote de Paxlovid. Según un aviso de los CDC, las personas que toman Paxlovid para COVID-19 podrían experimentar un rebrote de la infección entre dos y ocho días después de la recuperación inicial y tener una reaparición de los síntomas y volver a dar positivo en las pruebas de detección del virus.
Los CDC recomiendan que los pacientes que experimenten un rebrote de Paxlovid vuelvan a aislarse durante al menos cinco días. En la actualidad, la información sobre el rebote de Paxlovid es limitada, aunque los informes de casos muestran que la mayoría de los casos de rebote de COVID-19 son leves y no hay informes de casos graves.
Una gran parte de la confusión en torno a Paxlovid es la cantidad de mensajes contradictorios procedentes de Pfizer y los organismos gubernamentales.
En el sitio web de Pfizer sobre el Paxlovid, hay mensajes del tipo «tómelo bajo su propio riesgo». Por ejemplo, afirman que «existe información limitada sobre la seguridad y eficacia del uso de Paxlovid para tratar a personas con COVID-19 de leve a moderada». Y sin embargo, los funcionarios de la Casa Blanca están presionando, criticando a los médicos por ser demasiado reacios a prescribir el medicamento, y más recientemente la compra de más cursos de la droga.
Los CDC afirman que «existen pruebas limitadas en el mundo real sobre el beneficio de Paxlovid según el estado de vacunación, el grupo de edad y las condiciones de salud subyacentes» pero, al mismo tiempo, afirman que Paxlovid debería recetarse a los adultos elegibles para reducir el riesgo de hospitalización asociada a COVID-19. Apoyan esto señalando un estudio que utiliza un gran conjunto de datos de registros electrónicos de salud utilizando un modelo de riesgos proporcionales de Cox para estimar una tasa de hospitalización reducida en un 51 por ciento. Todavía no hay ningún nuevo ensayo clínico aleatorizado de control doble ciego ni datos del mundo real que confirmen este resultado.
Fuentes
https://www.researchsquare.com/article/rs-1705061/v1
https://emergency.cdc.gov/han/2022/han00467.asp
https://s28.q4cdn.com/781576035/files/doc_financials/2022/q1/Q1-2022-Earnings-Charts-FINAL-(1).pdf
https://www.cdc.gov/mmwr/volumes/71/wr/mm7125e1.htm
https://clinicaltrials.gov/ct2/show/study/NCT04960202
https://www.nejm.org/doi/full/10.1056/NEJMoa2118542
https://www.nytimes.com/2022/04/26/us/politics/covid-infections-ashish-jha.html
https://www.nytimes.com/2022/03/21/well/live/can-covid-symptoms-rebound-after-taking-paxlovid.html
https://www.reuters.com/world/us/us-cdc-director-tests-positive-covid-19-again-2022-10-31/
https://www.fda.gov/media/155051/download
https://www.fda.gov/media/155049/download
https://academic.oup.com/cid/advance-article/doi/10.1093/cid/ciac443/6599020
https://emergency.cdc.gov/han/2022/pdf/CDC_HAN_467.pdf
https://www.fda.gov/media/155050/download
https://www.fda.gov/media/158165/download
https://emergency.cdc.gov/han/2022/han00467.asp
https://www.nejm.org/doi/suppl/10.1056/NEJMoa2118542/suppl_file/nejmoa2118542_appendix.pdf
https://beta.clinicaltrials.gov/study/NCT04960202
https://www.medicaljournals.se/acta/download/10.1080/00015550310002611/
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.