Opinion
Coágulos extraños
Desde mediados del 2021, se notificaron en todo el mundo coágulos de sangre inusuales y prolongados encontrados en los vasos de pacientes de COVID-19 y receptores de inyecciones.

«Nosotros, como embalsamadores, estamos viendo algunos coágulos extraños desde el brote de COVID. Estos coágulos tienen una sensación muy gomosa y son muy largos al salir de las venas que utilizamos durante el procedimiento de embalsamamiento. Realmente parecen ser como lombrices de tierra. Nunca había visto esto en mi carrera hasta ahora», dijo Larry Mills, embalsamador y director de funeraria autorizado en el Estado de Alabama, a The Epoch Times.
Otros embalsamadores confirmaron hallazgos similares y hablaron bajo condición de anonimato.
Richard Hirschman, director de funeraria y embalsamador de Alabama desde 2001, fue uno de los primeros en llamar la atención sobre este fenómeno. Dijo que antes del COVID tal vez entre el 5 y el 10 por ciento de las personas tenían estos coágulos. Ahora, más de la mitad de los cuerpos que ve los tienen.
Un embalsamador, con licencia desde 2001, dijo en una entrevista: «Puedo decir con certeza que los coágulos que Richard mostró en Internet son un fenómeno que no presencié hasta probablemente mediados del año pasado. Eso es prácticamente todo lo que tengo que decir al respecto. No tengo conocimiento de la causa de los coágulos, pero parece que empezaron a aparecer a mediados del 2021».
¿De dónde vienen estos extraños coágulos fibrosos? ¿Cómo se forman?
Una enfermedad con más de 200 síntomas
Los médicos se dieron cuenta, desde los primeros días de la pandemia, de que el COVID-19 no es solo una enfermedad pulmonar, sino también una enfermedad endotelial y vascular.
Los médicos resumieron una lista de observaciones clínicas inusuales del COVID-19 que incluyen, entre otras, pacientes gravemente hipóxicos (con poco oxígeno) a pesar de una distensibilidad pulmonar relativamente normal al examinarlos, complicaciones trombóticas y hallazgos constantes en la autopsia de coágulos de sangre (trombos) en la microcirculación del pulmón.
Después de una infección aguda por COVID-19, se notificaron más de 200 síntomas persistentes diferentes para el COVID largo, que pueden persistir durante unos 6-24 meses.
Este es quizás el mayor número de síntomas reportados con una condición médica hasta ahora.
Los síntomas más frecuentes son disnea, fatiga, niebla cerebral, disfunción cognitiva, dolores musculares (mialgias), dificultades para dormir y ansiedad o depresión.
El carácter crónico y recidivante del COVID largo está causado principalmente por la desregulación inmunitaria, la hiperinflamación, el estrés oxidativo y la disfunción mitocondrial.
Pero, ¿cómo puede ser y por qué? Las pistas surgieron desde 2020.
Los coágulos de sangre que causan los síntomas
En noviembre del 2020, un informe con los hallazgos de un aumento de microcoágulos en los pacientes con COVID-19 frente a los sanos o diabéticos podría explicar razonablemente la disnea, la fatiga y el síndrome de malestar postesfuerzo.
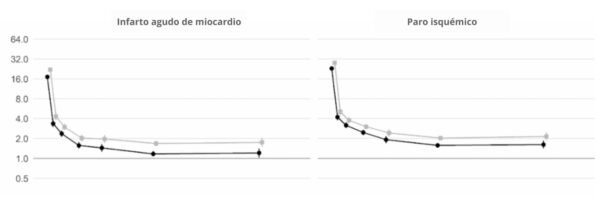
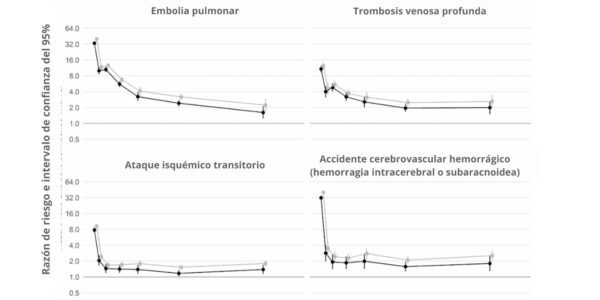
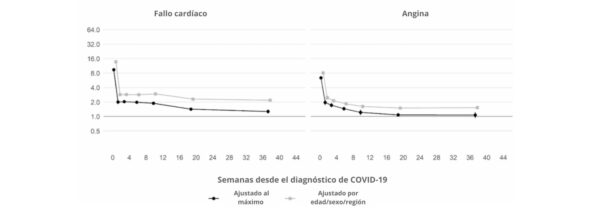
Además, un estudio británico de cohortes a gran escala basado en 48 millones de adultos de Inglaterra y Gales descubrió que, en la primera semana tras el diagnóstico de COVID-19, el riesgo de sufrir un coágulo arterial era casi 22 veces mayor que en alguien sin COVID-19, y 33 veces mayor en el caso de una afección venosa.
Un coágulo arterial es el que podría causar un ataque al corazón o un accidente cerebrovascular isquémico al bloquear el flujo de sangre al corazón o al cerebro.
Se calcula que esto provocó 10,500 casos adicionales de problemas relacionados con los coágulos, es decir, unos 7200 infartos o derrames cerebrales adicionales, y 3500 casos más de embolia pulmonar, trombosis venosa profunda u otros problemas venosos.
Aunque ese riesgo desciende bruscamente a menos de cuatro veces más que el de alguien sin COVID en la segunda semana, sigue siendo alto (2 veces) incluso hasta 49 semanas después del diagnóstico inicial. Esto es especialmente cierto en lo que respecta al riesgo de trombosis venosa profunda. Se trata de coágulos que se forman en las venas grandes.
Proteína de espiga: El primer dominó derribado
La sangre es un líquido que circula a presión por los vasos sanguíneos de todo nuestro cuerpo, como el agua que fluye por la casa y que luego utiliza para ducharte, fregar los platos, etc.
Tras una lesión vascular, la sangre que se «escapa» debe convertirse rápidamente en un gel (un «coágulo») para rellenar el agujero y minimizar la pérdida de sangre.
Normalmente, la porción de plasma de la sangre contiene un conjunto de proteínas solubles que actúan juntas en una serie de eventos de activación enzimática que dan lugar a la formación de un coágulo de fibrina. Este proceso es protector, ya que evita la pérdida excesiva de sangre tras una lesión.
Desgraciadamente, el mecanismo de coagulación de la sangre también puede conducir a la formación de coágulos no deseados en el interior de los vasos sanguíneos (trombosis patológica), por ejemplo, un infarto de miocardio o un accidente cerebrovascular, ambas causas principales de discapacidad y muerte en el mundo.
La forma en que el COVID-19 provoca coágulos sanguíneos anormales suscitó muchos debates desde principios del 2020.
Parece ser que la proteína de espiga única del virus desencadena la cascada a través de muchas vías «no tradicionales».
La invasión directa de las células del epitelio por parte de la proteína de la espiga es la primera ficha de dominó que se derriba.
Los efectos posteriores en cascada provocan finalmente la coagulación de la sangre.
La proteína de la espiga afecta a las células del epitelio
El SARS-CoV-2 entra en nuestras células a través de un receptor proteico llamado enzima convertidor de angiotensina 2 (ACE2).
Las células endoteliales (CE), expresan una abundancia de ACE2. Las CE residen en la superficie interna de todos los vasos sanguíneos de nuestro cuerpo, lo que las convierte en un objetivo directo de la infección por el virus.
Los estudios demostraron que la propia proteína de la espiga puede dañar la estructura y la función de las CE, incluyendo el deterioro de las mitocondrias y la regulación a la baja de la molécula protectora ACE2 en las CE.
Los investigadores observaron que las partes S1 y S2 de la proteína de la espiga pueden inducir a las CE humanas a expresar un pico de citoquinas proinflamatorias (IL6, IL1B, TNF-alfa y quimiocinas CXCL1 y CXCL2).
Posteriormente, la liberación de citocinas inicia la molécula tipo interruptor (E-selectina) en la membrana de las células endoteliales, lo que les permite unirse a las células inmunitarias, iniciando así los procesos posteriores de la enfermedad.
Estudios adicionales sobre la proteína de la espiga demostraron que activa la inflamación de la CE dependiente de las vías de señalización de la integrina ⍺5β1 y del NF-κB y la posterior expresión de las moléculas de adhesión leucocitaria.
Las citoquinas son pequeñas proteínas secretadas por las células (principalmente células T y macrófagos). Tienen muchos nombres específicos y sirven de comunicador entre las células (señalización celular) para su posterior actuación. Las citocinas son los «mensajeros» del cuerpo que conectan y comunican entre las células.
La proteína de la espiga puede inducir una ruptura de las proteínas de conexión entre las células endoteliales de los vasos sanguíneos, lo que perturba la integridad y la función de nuestros vasos sanguíneos.
Las CE del cerebro también expresan fuertemente la ACE2. La proteína de espiga tiene efectos tóxicos similares en las CE del cerebro, induciendo síntomas neurológicos (niebla cerebral, deterioro cognitivo).
Las proteínas de espiga desencadenan la cascada de coagulación
Muchas otras células, como las células epiteliales del pulmón, los enterocitos que recubren el intestino delgado y los pericitos cardíacos, expresan la ACE2.
Las proteínas de espiga no solo activan las células epiteliales (CE) y promueven la inflamación localizada. También promueven la inflamación sistémica, ya que la ACE2 está en casi todas partes dentro de nuestros principales órganos y tejidos.
En consecuencia, se expresan más genes proinflamatorios. Cada vez se atraen más células inmunitarias y se envían a los tejidos lesionados o infectados (vasos del pulmón, corazón, intestino, etc.).
Una serie de acontecimientos posteriores contribuyen colectivamente a la cascada de coagulación:
1. Inflamación de los epitelios mediada por el complemento (endotelitis): El acoplamiento de las proteínas de la espiga en los CE de la ACE2 activa la vía del complemento y la cascada de la coagulación, lo que provoca una endotelitis sistémica (lesión pulmonar) y un estado procoagulante (tendencia a desarrollar coágulos sanguíneos).
2. A medida que el complemento destruye el endotelio, se liberan el factor procoagulante von Willebrand (FvW) y el FVIII. Un aumento significativo del vWF puede formar multímeros que promueven el crecimiento del trombo. El vWF se segrega principalmente de las células endoteliales y de los gránulos a de las plaquetas (derivados de los megacariocitos). Es comparable al cordón de las «perlas y el cordón» de un collar en el que las perlas representan las plaquetas.
3. Tormenta de plaquetas: Las plaquetas son un pequeño fragmento de los megacariocitos. Las anafilotoxinas del complemento C3a y C5a activan las plaquetas y aumentan la producción de factor tisular, promoviendo además un estado de formación de coágulos.
Los receptores ACE2 están presentes en las plaquetas, y esto puede contribuir a la agregación plaquetaria masiva, que es una característica de la infección grave por COVID-19.
4. La activación de los neutrófilos conduce a la formación de trampas extracelulares de neutrófilos (NETs), un proceso a veces denominado NETosis, que contribuye a la trombosis.
5. La lesión de las CE se ve agravada por la activación del receptor tipo Toll (TLR) por el reconocimiento del ARN viral, con el consiguiente aumento de la producción de especies oxidativas reactivas (ROS). El aumento de ROS regula aún más la expresión de vWF.
6. La proteína de la espiga puede inducir la expresión y la secreción de una serie de proteínas de la coagulación que entran en cascada en el proceso de coagulación, incluyendo el factor (F)-V, la trombina y el fibrinógeno para promover el proceso de coagulación.
La proteína espiga desregula el SRAA, empeorando el estado de coagulación
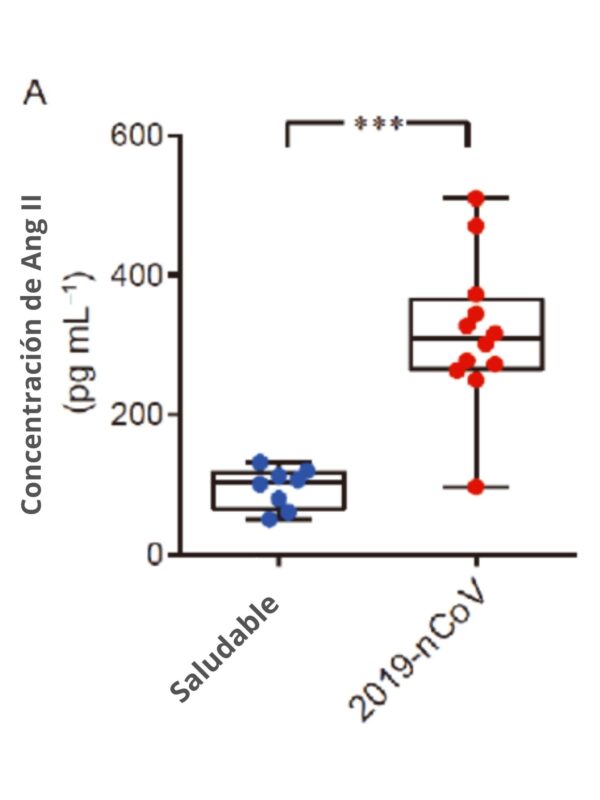
Debido a que la proteína de espiga interactúa directamente con la expresión de ACE2, los pacientes de COVID-19 mostraron un nivel elevado de angiotensina II en suero, lo que indica una desregulación del sistema RAA (sistema renina angiotensina aldosterona, o RAAS).
Tradicionalmente, se piensa que la angiotensina II es una neurohormona que estimula la constricción de las células musculares lisas vasculares y es responsable del equilibrio de la sal y el agua.
Sin embargo, se realizaron abundantes estudios que apoyan la idea de que la angiotensina II es capaz de iniciar y aumentar las respuestas inflamatorias, empeorando el estado de la coagulación.
En una respuesta inmunitaria regulada y autolimitada, estos mecanismos ayudan a calmar la lesión local, con la consiguiente curación y vuelta a un estado de reposo de la CE.
Sin embargo, en el caso de los pacientes predispuestos al COVID-19 o de las personas vacunadas, los factores que refuerzan la formación de coágulos son mucho más pesados que los mecanismos de curación, todo lo cual conduce a una cascada trombótica creciente.
He aquí un breve resumen de la primera escena de la historia del coágulo:
interrupción endotelial inducida por un pico, liberación de cantidades masivas de FvW, una tormenta de plaquetas subsiguiente, aumento y activación del FvW inducido por la hipoxia, red fibrosa procedente de las trampas extracelulares de neutrófilos (NET), así como aumento del nivel de angiotensina II, todo ello sumado para iniciar la trombogénesis.
Así es como surge el mecanismo de coagulación. Además, la segunda escena que se avecina tiene otro papel fundamental en toda la historia.
La vacuna COVID instruye a las células para que produzcan grandes cantidades de proteínas de espiga. Los procesos bioquímicos y fisiológicos normales son «secuestrados» para producir una cantidad anormal de estas proteínas de espiga.
Estas cantidades anormales de proteínas de espiga tienen efectos directos más sorprendentes sobre los coágulos.
Las proteínas de espiga interrumpen directamente el mecanismo de disolución de los coágulos
En una persona sana normal, el cuerpo, en presencia de un coágulo de sangre, lo descompone mediante un proceso de fibrinólisis. Se trata de un mecanismo natural de curación y equilibrio para evitar la abundancia de coágulos.
Durante este proceso, el activador del plasminógeno tisular (TPA, procedente del endotelio) ayuda a que el plasminógeno se transforme en plasmina y, a continuación, genere dímero (un pequeño fragmento de proteína que queda cuando se disuelve un coágulo de sangre).
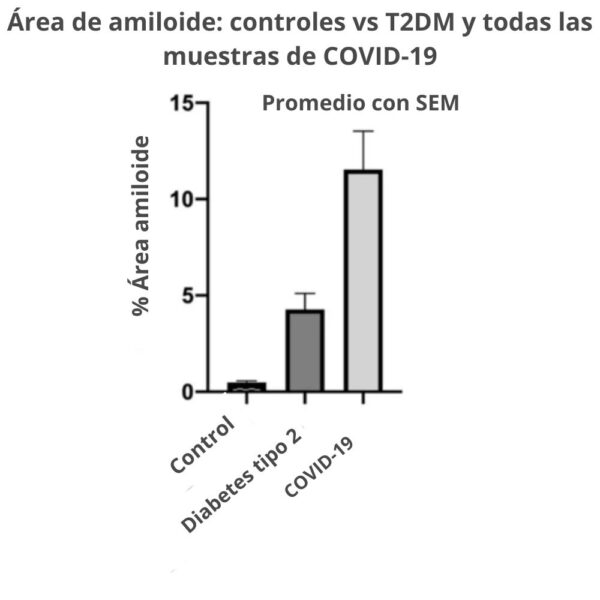
Se descubrió que el fibrinógeno de la sangre puede coagularse en una forma «amiloide» anormal de fibrina que (como otros amiloides ricos en β y los priones) es relativamente resistente a la proteólisis (fibrinólisis).
Esto se manifiesta fuertemente en el plasma pobre en plaquetas (PPP) de los individuos con COVID largo. Los extensos microcoágulos de fibrina amiloide pueden persistir.
En un destacado estudio de Grobbelaar publicado en Bioscience Reports en agosto del 2021, el biomarcador S1 (o la parte intrínseca de la proteína de espiga) por sí solo puede inducir la resistencia de la fibrina a la fibrinólisis, lo que lleva a la formación de microcoágulos sin oposición.
Cuando se añadió la proteína de espiga S1 a la APP sana, se produjeron cambios estructurales en la fibrina β y γ(ogen), el complemento 3 y la protrombina. Estas proteínas fueron sustancialmente resistentes a la tripsinización en presencia de la proteína de punta S1.
Por lo tanto, los resultados sugieren que la presencia de la proteína de espiga en la circulación puede contribuir al estado de hipercoagulación, y puede causar un deterioro sustancial del proceso de disolución del coágulo.
Tal deterioro lítico puede resultar en los grandes microcoágulos persistentes que la gente reportó y que fueron encontrados en muestras de plasma de pacientes de COVID-19.
Estos microcoágulos bloquean los capilares y, por lo tanto, limitan el paso de los glóbulos rojos y, por ende, el intercambio de oxígeno, lo que puede ser la base de la mayoría de estos síntomas.
Las proteínas de la espiga forman una sustancia similar al amiloide
Además, para sorpresa de todos de nuevo, se identificó que las proteínas de espiga presentan siete secuencias amiloidógenas y son capaces de formar sustancias similares al amiloide.
En otras palabras, estas proteínas de espiga son similares a esas sustancias similares a la beta-amiloide o a la tau o a la alfa-sinucleína que pueden causar la pérdida neuronal en los pacientes de la enfermedad de Alzheimer o de Parkinson.
Su estructura facilita la formación de estructuras unidas en forma de cuerda, con torsión longitudinal y unión cruzada, formando una estructura similar a una fibra visible al microscopio.
Los investigadores descubrieron que las muestras de plasma de pacientes con COVID de larga duración siguen conteniendo grandes depósitos anómalos (amiloides) (microcoágulos), que son resistentes a la fibrinólisis (en comparación con el plasma de los controles y de la diabetes), incluso después de la tripsinización (disociación de las células después de que una enzima descomponga las proteínas).
Tras una segunda tripsinización, se solubilizaron los depósitos de plaquetas persistentes (microcoágulos). Varias moléculas inflamatorias aumentaron sustancialmente tanto en el sobrenadante como en los depósitos de plaquetas solubilizados de COVID-19, frente a los de las muestras de control.
Resulta especialmente interesante el aumento sustancial de la α(2)-antiplasmina (α2AP), de varias cadenas de fibrinógeno, así como del amiloide sérico (SAA) que quedaron atrapados en los depósitos de pellets resistentes a los fibrinolíticos solubilizados.
La formación significativa de microcoágulos amiloides anormales que son resistentes a la fibrinólisis, el aumento de α2AP, y el aumento de las moléculas inflamatorias de fase aguda pueden, por lo tanto, ser contribuyentes centrales tanto en la infección por COVID-19 como en el síndrome relacionado con la vacuna COVID.
La proteína de espiga inhibe otro mecanismo anticoagulante
La proteína de espiga es una sorpresa tras otra.
Se informó que la proteína de espiga puede inhibir competitivamente las uniones de la antitrombina y el cofactor II de la heparina, causando un aumento anormal de la actividad de la trombina (coagulación).
Las proteínas de pico del SARS-CoV-2 a una concentración similar (~10 μg/mL) a la de la carga viral en pacientes críticos pueden causar directamente coagulación sanguínea y trombosis en el modelo de pez cebra.
En resumen, estos efectos negativos inesperados de la proteína de espiga en el proceso de disolución de los coágulos sanguíneos, además de su naturaleza amiloide, pueden ser los factores clave que contribuyen a los coágulos fibrosos anormales y largos observados en las condiciones relacionadas con el COVID.
La proteína de la espiga es el arma de fuego
Existen pruebas clínicas de que la proteína de espiga del SARS-CoV-2 se detectó en coágulos extraídos de pacientes con COVID-19 con ictus isquémico agudo e infarto de miocardio.
Una investigación reciente llevada a cabo por cardiólogos de la Universidad de Colorado arroja luz sobre el papel crucial de la proteína espiga en la patología de las lesiones relacionadas con la vacuna COVID y COVID.
Analizaron a siete pacientes con COVID-19 y a seis pacientes vacunados con ARNm con lesiones miocárdicas y encontraron alteraciones casi idénticas en los patrones de los perfiles genéticos que los predispondrían al estado de coagulación, la inflamación y la disfunción miocárdica.
En otras palabras, independientemente de que la miocarditis fuera causada por el virus o por la vacuna, la expresión de los genes responsables del estado protrombótico en respuesta a la proteína de la espiga, la inflamación y la disfunción miocárdica, presentaban cambios similares.
Basándose en el análisis de los genes, la lesión por COVID-19 y la lesión por vacuna post-mRNA tienen un mecanismo molecular común.
El patrón de genes alterados incluye la regulación a la baja de ACE2, la relación ACE2/ACE, AGTR1 e ITGA5, y la regulación al alza de ACE y F3 (factor tisular).
Lo que es más alarmante y no se había informado antes es que se encontró trombosis microvascular en pacientes post-vacunados, lo que indica que la propia proteína de la espiga es capaz de desencadenar coágulos de sangre en pacientes susceptibles.
La punta del iceberg
Basándose en la relación causal entre las vacunas ChAdOx1-S (la vacuna COVID de AstraZeneca contra el adenovirus) y la trombosis con síndrome de trombocitopenia, se actualizó la información del producto ChAdOx1-S para incluir la trombosis con síndrome de trombocitopenia como un efecto secundario muy raro.
Este efecto se denominó trombocitopenia inmunitaria inducida por la vacuna (VITT), debido a que en casi todos los pacientes de estos informes se identificaron altos niveles de anticuerpos contra los complejos de factor plaquetario 4 (PF4) y polianión en su organismo.
Estos inusuales coágulos de sangre en combinación con la trombocitopenia se notificaron predominantemente en mujeres menores de 60 años. En consecuencia, varios países europeos restringieron el uso de las vacunas contra el adenovirus en los grupos de edad más jóvenes.
Recientemente se analizó sistemáticamente este riesgo en un estudio internacional de cohortes en red de cinco países europeos y Estados Unidos, confirmando un aumento del 30 por ciento del riesgo conjunto de trombocitopenia tras una primera dosis de la vacuna ChAdOx1-S, así como una tendencia al aumento del riesgo de trombosis venosa con síndrome de trombocitopenia tras Ad26.COV2.S (la vacuna COVID de Janssen) en comparación con BNT162b2 (la vacuna COVID de Pfizer-BioNTech).
Sin embargo, esto puede ser solo la punta del iceberg. Hay muchos más acontecimientos que podrían atribuirse a los problemas de coagulación, como la muerte súbita, los acontecimientos cardiovasculares, la muerte cardíaca, los accidentes cerebrovasculares, las discapacidades, los acontecimientos trombóticos, etc.
Los vasos sanguíneos están en todos nuestros órganos. Los problemas vasculares podrían explicar una amplia gama de síntomas, desde la disfunción hasta el deterioro leve de nuestro cerebro, corazón, pulmón y extremidades.
Con información adicional de Enrico Trigoso.
Las opiniones expresadas en este artículo son las del autor y no reflejan necesariamente la opinión de The Epoch Times.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.





