La revisión de la solicitud de Pfizer para la aprobación de su vacuna COVID-19 se completará probablemente en enero de 2022, según anunciaron el viernes los organismos reguladores de medicamentos de Estados Unidos.
La Administración de Alimentos y Medicamentos de EE. UU. (FDA) acordó dar prioridad a la solicitud.
Los funcionarios de la FDA concedieron en diciembre de 2020 la autorización de uso de emergencia a las vacunas COVID-19 de Pfizer y Moderna. La única otra inyección que se ha autorizado desde entonces para su uso en Estados Unidos es una de Johnson & Johnson.
Las tres empresas han solicitado o tienen la intención de solicitar la aprobación completa, que requiere más datos y una revisión más exhaustiva.
La Dra. Janet Woodcock, comisionada interina de alimentos y medicamentos de la FDA, dijo que los reguladores tienen como objetivo enero de 2022 para terminar con la revisión, pero el objetivo «no significa que la aprobación no se producirá antes de ese momento».
«Todo lo contrario, la revisión de esta BLA ha estado en curso, está entre las más altas prioridades de la agencia, y la agencia tiene la intención de completar la revisión con mucha antelación» de esa fecha límite, dijo en un comunicado.
Pfizer terminó de presentar la solicitud de aprobación, conocida formalmente como solicitud de licencia biológica (BLA, en inglés), en mayo. Incluye datos clínicos de un ensayo de fase 3 que, según Pfizer y su socio, BioNTech, demostró que la vacuna era un 91.3% eficaz contra el COVID-19 y un 100% contra la enfermedad grave.
El COVID-19 es la enfermedad causada por el virus del PCCh (Partido Comunista Chino).
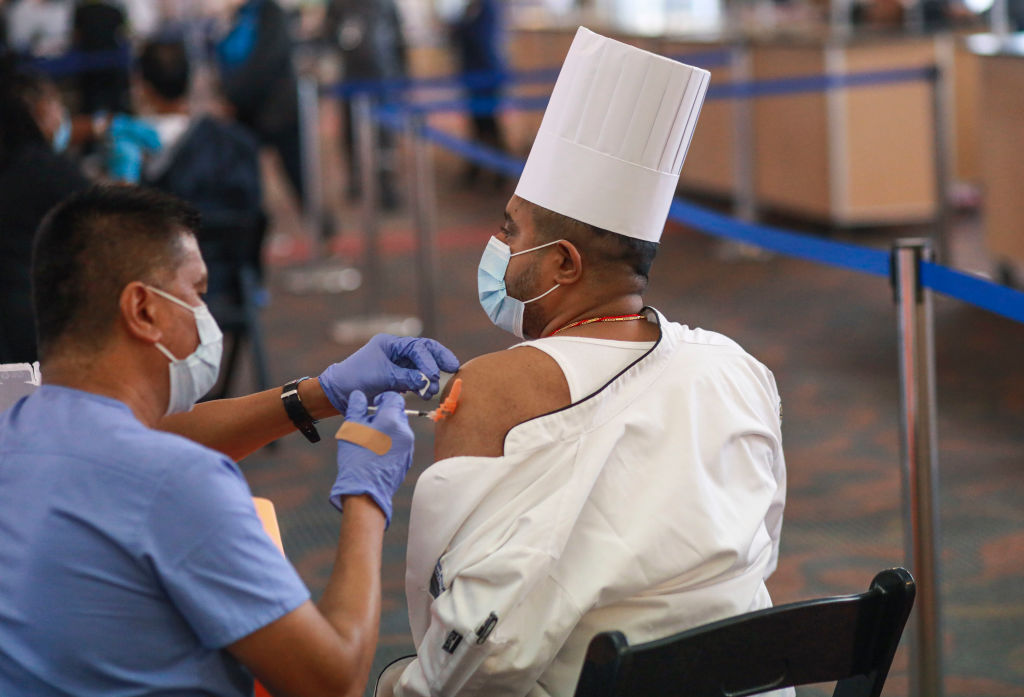
Pfizer es la vacuna COVID-19 más utilizada en el país. Hasta el viernes se habían administrado casi 187 millones de dosis, frente a 136 millones de dosis de Moderna y solo 12.9 millones de dosis de Johnson & Johnson.
La inyección de Pfizer es la única autorizada para su uso en niños de entre 12 y 17 años. Moderna solicitó el mes pasado a la FDA la autorización para ese grupo de edad, después de que un ensayo demostrara que era 100% eficaz en esa población.
En junio, Moderna también solicitó la aprobación total de la vacuna.
Casi la mitad de la población total de Estados Unidos está totalmente vacunada contra el virus del PCCh, pero las autoridades estadounidenses han seguido impulsando agresivamente las vacunas, alegando que son la única forma de garantizar la protección contra la enfermedad.
La doctora Rochelle Walensky, directora de los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés), dijo a los periodistas en una sesión informativa virtual celebrada el jueves que los datos muestran que «esto se está convirtiendo en una pandemia de los no vacunados».
«Estamos viendo brotes de casos en partes del país que tienen una baja cobertura de vacunación porque las personas no vacunadas están en riesgo. Y a las comunidades que están totalmente vacunadas les va bien en general», dijo.
Los CDC no han respondido a una solicitud de datos que respalden esta afirmación, que Walensky ha promovido en múltiples apariciones recientes.
Los críticos señalan que las personas que contraen el COVID-19 y se recuperan gozan de una inmunidad duradera, un hecho al que la FDA y los CDC restan importancia.
El desarrollo de la solicitud de Pfizer se produjo una semana después de que la empresa anunciara que pediría a la FDA que autorizara una dosis de refuerzo de su vacuna, alegando que las personas se enfrentan a un riesgo de reinfección seis meses después de recibir el tratamiento original de dos dosis. Sin embargo, tanto la FDA como los centros de salud afirmaron que dicha dosis de refuerzo no es necesaria en este momento.
Tras una reunión esta semana en la que participaron funcionarios estadounidenses y empleados de Pfizer, el director de Salud Pública Vivek Murthy dijo que es «muy posible» que se necesite un refuerzo, aunque un funcionario de salud dijo que los refuerzos podrían aumentar el riesgo de efectos secundarios graves.
Siga a Zachary en Twitter: @zackstieber
Siga a Zachary en Parler: @zackstieber
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.