Gotas oftálmicas son retiradas del mercado en todo el país por estar potencialmente contaminadas con hongos y plantean riesgos para la salud de los usuarios.
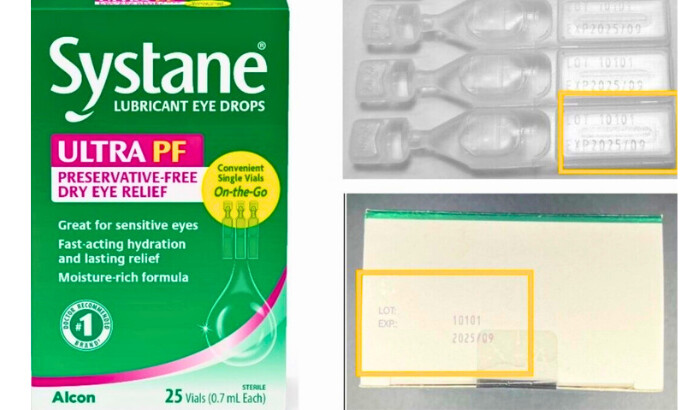
El producto retirado es un lote de «Systane Lubricant Eye Drops Ultra PF, Single Vials On-the-Go» fabricado por Alcon Laboratories, con sede en Suiza, según un aviso de retiro publicado el 23 de diciembre por la Administración de Alimentos y Medicamentos de EE.UU. (FDA).
Las personas que padecen síntomas de ojo seco utilizan el producto para aliviar temporalmente la irritación y la sensación de quemazón.
«Alcon evaluó la queja de un consumidor sobre un material extraño observado en el interior del vial sellado de un solo uso y determinó que el material era de naturaleza fúngica», se lee en el aviso.
«Se sabe que la contaminación por hongos de un producto oftálmico puede causar infecciones oculares», añade. «Si se produce una infección, puede poner en peligro la visión y, en casos muy raros, potencialmente mortal en pacientes inmunodeprimidos».
Los artículos se distribuyeron a través de tiendas físicas y se enviaron a partir de compras por Internet.
Alcon pide a los consumidores que compraron el producto retirado que «dejen de utilizarlo inmediatamente». Los consumidores pueden devolver el artículo al lugar de compra y obtener un reemplazo o un reembolso.
La empresa aconsejó a los consumidores que se pusieran en contacto con un médico si experimentaban alguna molestia después de utilizar el artículo. Alcon dijo que aún no recibió informes de personas que hayan sufrido efectos adversos por el producto retirado.
Se pidió a los minoristas y distribuidores que tuvieran existencias de estos productos que se deshicieran de ellos.
El producto puede identificarse por su número de lote 10101, diseño de cartón rosa y verde, caducidad en septiembre de 2025 y mención de «ULTRA PF» y «Systane» en el cartón. El envase contiene 25 ampolletas. Alcon dijo que estaba notificando a distribuidores y clientes sobre el producto contaminado.
En los últimos años se produjeron retiradas similares de gotas oftálmicas. En octubre de 2023, Cardinal Health, con sede en Ohio, retiró ciertos colirios suministrados por Velocity Pharma, alegando el riesgo de infecciones oculares.
En agosto de 2023, Dr. Berne’s Whole Health Products, con sede en Nuevo México, retiró sus productos de gotas oftálmicas por riesgo de contaminación fúngica y bacteriana. La empresa recibió dos informes de efectos adversos relacionados con el uso de los productos.
Según la FDA, productos como las gotas oftálmicas presentan un «mayor riesgo de daño», ya que eluden alguna de las defensas naturales del organismo. De ahí que la esterilidad sea un aspecto crucial a tener en cuenta a la hora de utilizar gotas oftálmicas.
Algunos ingredientes, como el sulfato de plata o el metilsulfonilmetano, no son adecuados para su uso en gotas oftálmicas, según la FDA, que sugiere a los consumidores que comprueben la etiqueta para asegurarse que el producto no contenga estos ingredientes.
«Lávese las manos con agua y jabón antes de usar gotas para los ojos y no toque la punta del frasco de gotas para los ojos con las manos, los ojos, la ropa o cualquier otra superficie para evitar la contaminación», dijo la agencia.
«Deje de utilizar las gotas oftálmicas si experimenta cualquier problema durante el uso de los productos, como secreción del ojo, dolor, cambios en la visión o malestar».
Retiro de la solución nasal
El 20 de diciembre, Endo Inc., con sede en Pensilvania, anunció el retiro voluntario del mercado de varios lotes de solución de cloruro de adrenalina (solución nasal EPINEPHrine).
Los artículos se vendieron en frascos de 30 mililitros y se distribuyeron en todo el país a entidades mayoristas entre el 10 de octubre de 2023 y el 11 de diciembre de 2024. Sus fechas de caducidad oscilaban entre enero de 2025 y marzo de 2026.
«Este producto, que es anterior a la Ley Federal de Alimentos, Medicamentos y Cosméticos de 1938, nunca se sometió a la aprobación de la FDA y, como tal, es un medicamento no aprobado cuya seguridad y eficacia no se han establecido y, por lo tanto, está sujeto al retiro del mercado», se lee en el aviso.
La FDA también determinó que la etiqueta engañosa del producto parecía similar a la de otro producto fabricado por la misma empresa, Adrenalin (inyección de epinefrina), que ya recibió la aprobación de la agencia.
La similitud de las etiquetas dificulta la distinción entre ambos productos, «lo que puede dar lugar a posibles errores de administración», según el aviso, que también advierte que el uso del producto retirado puede tener graves consecuencias para la salud.
«Existe una alta probabilidad de que la administración intravenosa del producto nasal dé lugar a que los pacientes reciban una dosis incorrecta de epinefrina en situaciones de emergencia para afecciones graves y potencialmente mortales, como el tratamiento de la anafilaxia, el apoyo a la presión arterial y los paros cardíacos», se lee en el aviso.
En septiembre, Green Pharmaceuticals Inc., con sede en California, retiró su aerosol nasal SnoreStop debido a una posible contaminación microbiana.
Los artículos se comercializaban para su uso entre personas mayores de 5 años. Según la FDA, el producto hacía «afirmaciones no probadas» que abriría las vías respiratorias y aliviaría la congestión nasal de los usuarios.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo clic aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.