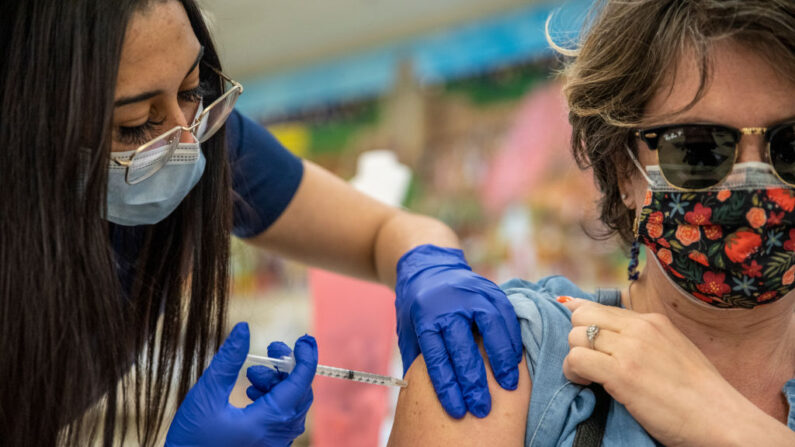
Moderna dijo el miércoles que terminó su solicitud a los reguladores de medicamentos para la aprobación de su vacuna anti-COVID, mientras que Pfizer y BioNTech comenzaron su solicitud para que su vacuna anti-COVID sea usada también en dosis de refuerzo.
«Esta presentación de BLA para nuestra vacuna anti-COVID, que comenzamos en junio, es un hito importante en nuestra batalla contra el COVID-19 y para Moderna, ya que es la primera presentación de BLA en la historia de nuestra empresa», dijo en un comunicado Stéphane Bancel, CEO de Moderna, refiriéndose a la Solicitud de Licencia de Biológicos.
Moderna comenzó a enviar secciones de la solicitud en junio y periódicamente envió más datos a la Administración de Alimentos y Medicamentos (FDA), incluidos datos clínicos de un ensayo clínico de fase 3 que inscribió a más de 30,000 participantes y se llevó a cabo en colaboración con el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) y otras dos agencias.
Según la firma de biotecnología con sede en Massachusetts, el ensayo mostró que la vacuna tenía un 93 por ciento de efectividad para prevenir la infección por el virus del PCCh (Partido Comunista Chino), que causa el COVID-19.
La Administración de Alimentos y Medicamentos no respondió de inmediato una solicitud de comentarios.
La solicitud de Moderna se completó dos días después de que la FDA aprobó la vacuna Pfizer-BioNTech.
En una conversación con la prensa el lunes, un alto funcionario de la FDA se negó a dar información sobre la solicitud de Moderna.
Pero el Dr. Peter Marks, un funcionario, señaló que pasaron 97 días entre la finalización de la solicitud por parte de Pfizer y la aprobación de la solicitud.
Eso fue un 40 por ciento más rápido que el período de tiempo normal «para una presentación de esta magnitud», dijo Marks.
Los funcionarios revisaron decenas de miles de páginas de datos de seguridad y eficacia antes de aprobar la vacuna de Pfizer, además de las visitas a las instalaciones de fabricación.
Por su parte, Pfizer y BioNTech dijeron el miércoles que comenzaron el proceso de solicitud de licencia de productos biológicos para la tercera dosis, o un refuerzo, de su vacuna.
La solicitud se considera una formalidad después de que las autoridades sanitarias anunciaran a principios de este mes que recomendarán el refuerzo para todos los adultos, incluso los sanos, una vez que se apruebe.
Solo tres empresas farmacéuticas han administrado sus vacunas anti-COVID en Estados Unidos desde que la enfermedad apareció por primera vez en el país. Las vacunas producidas por Pfizer y Moderna, que utilizan tecnología de ARN mensajero, son, con mucho, las más utilizadas.
Hasta el 24 de agosto se han administrado más de 205 millones de dosis de Pfizer y más de 143 millones de dosis de Moderna, según datos federales. Esas cifras contrastan con los 14 millones de dosis de Johnson & Johnson.
A diferencia de la vacuna de Johnson & Johnson, las vacunas de Pfizer y Moderna se administran en regímenes de dos dosis. Las dosis se administran con varias semanas de diferencia.
Sin embargo, las autoridades sanitarias han anunciado recientemente que todo tipo de personas deben recibir una dosis de refuerzo si se han vacunado con Pfizer o Moderna. Es probable que se haga una recomendación similar para la vacuna única de Johnson & Johnson, según las autoridades.
Johnson & Johnson aún no ha presentado una solicitud de licencia de productos biológicos para su vacuna anti-COVID.
El Dr. Anthony Fauci, quien dirige el NIAID, dijo en «CBS This Morning» esta semana que la aprobación a las vacunas de Moderna y Johnson & Johnson probablemente no se tarde mucho.
“Creo que es un problema temporal. No creo que haya algo necesariamente diferente en el proceso, es solo que enviaron o están enviando su material un poco más tarde o después de que lo hiciera Pfizer”, agregó.
Únase a nuestro canal de Telegram para recibir las últimas noticias al instante haciendo click aquí
Cómo puede usted ayudarnos a seguir informando
¿Por qué necesitamos su ayuda para financiar nuestra cobertura informativa en Estados Unidos y en todo el mundo? Porque somos una organización de noticias independiente, libre de la influencia de cualquier gobierno, corporación o partido político. Desde el día que empezamos, hemos enfrentado presiones para silenciarnos, sobre todo del Partido Comunista Chino. Pero no nos doblegaremos. Dependemos de su generosa contribución para seguir ejerciendo un periodismo tradicional. Juntos, podemos seguir difundiendo la verdad.